Bula/rótulo do produto
Nome genérico: dulaglutida
Forma farmacêutica: injeção, solução
Classe de drogas: Miméticos de incretina
1. Indicações e uso para Trulicity
TRULICIDADE® é indicado:
- Como complemento à dieta e exercício para melhorar o controle glicêmico em adultos e pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2.
- Para reduzir o risco de eventos cardiovasculares adversos importantes (morte cardiovascular, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal) em adultos com diabetes mellitus tipo 2 que tenham doença cardiovascular estabelecida ou múltiplos fatores de risco cardiovascular.
Limitações de uso
TRULICIDADE:
- Não foi estudado em pacientes com histórico de pancreatite. Considere outras terapias antidiabéticas em pacientes com histórico de pancreatite.
- Não deve ser utilizado em pacientes com diabetes mellitus tipo 1.
- Não foi estudado em pacientes com doença gastrointestinal grave, incluindo gastroparesia grave e, portanto, não é recomendado nestes pacientes.
2. Dosagem e Administração de Trulicity
2.1 Dosagem para Adultos
- A dosagem inicial recomendada de TRULICITY é de 0,75 mg injetada por via subcutânea uma vez por semana.
- Aumente a dosagem para 1,5 mg uma vez por semana para controle glicêmico adicional.
- Se for necessário controle glicêmico adicional, aumente a dosagem em incrementos de 1,5 mg após pelo menos 4 semanas com a dosagem atual.
- A dosagem máxima recomendada é de 4,5 mg injetada por via subcutânea uma vez por semana.
2.2 Dosagem Pediátrica
- A dosagem inicial recomendada de TRULICITY é de 0,75 mg injetada por via subcutânea uma vez por semana.
- Se for necessário controle glicêmico adicional, aumente a dosagem para a dosagem máxima recomendada de 1,5 mg uma vez por semana após pelo menos 4 semanas com a dosagem de 0,75 mg.
2.3 Recomendações relativas à dose perdida
- Se uma dose for esquecida, instrua os pacientes a administrá-la o mais rápido possível se faltarem pelo menos 3 dias (72 horas) até a próxima dose programada. Se faltarem menos de 3 dias para a próxima dose programada, pule a dose esquecida e administre a próxima dose no dia regularmente programado. Em cada caso, os pacientes podem então retomar o seu esquema posológico regular, uma vez por semana.
- O dia da administração semanal pode ser alterado, se necessário, desde que a última dose tenha sido administrada 3 ou mais dias antes do novo dia de administração.
2.4 Instruções Importantes de Administração
- Antes do início, treine pacientes e cuidadores sobre a técnica de injeção adequada.
- Administre TRULICITY uma vez por semana, a qualquer hora do dia, com ou sem alimentos.
- Injete TRULICITY por via subcutânea no abdômen, coxa ou parte superior do braço.
- Alterne os locais de injeção com cada dose.
- Inspecione TRULICITY visualmente antes de usar. Deve parecer claro e incolor. Não use TRULICITY se houver partículas ou coloração.
- Ao usar TRULICITY com insulina, administre em injeções separadas e nunca misture. É aceitável injetar TRULICITY e insulina na mesma região do corpo, mas as injeções não devem ser adjacentes uma à outra.
3. Formas farmacêuticas e dosagens
Injeção: TRULICITY é uma solução límpida e incolor disponível como:
- Solução de 0,75 mg/0,5 mL em caneta unidose
- Solução de 1,5 mg/0,5 mL em caneta unidose
- Solução de 3 mg/0,5 mL em caneta unidose
- Solução de 4,5 mg/0,5 mL em caneta unidose
4. Contra-indicações
TRULICITY está contra-indicado em pacientes com:
- História pessoal ou familiar de carcinoma medular de tireoide (CMT) ou em pacientes com síndrome de neoplasia endócrina múltipla tipo 2 (MEN 2) .
- Reação grave de hipersensibilidade ao dulaglutido ou a qualquer um dos componentes do produto. Reações graves de hipersensibilidade, incluindo reações anafiláticas e angioedema, foram relatadas com TRULICITY.
5. Advertências e precauções
5.1 Risco de tumores de células C da tireoide
Em ratos machos e fêmeas, o dulaglutido causa um aumento relacionado com a dose e dependente da duração do tratamento na incidência de tumores das células C da tiróide (adenomas e carcinomas) após exposição ao longo da vida. Os agonistas do receptor do peptídeo-1 semelhante ao glucagon (GLP-1) induziram adenomas e carcinomas de células C da tireoide em camundongos e ratos com exposições clinicamente relevantes. Não se sabe se TRULICITY causará tumores de células C da tireoide, incluindo carcinoma medular de tireoide (CMT), em humanos, uma vez que a relevância humana dos tumores de células C da tireoide de roedores induzidos por dulaglutida não foi determinada.
Um caso de CMT foi relatado em um paciente tratado com TRULICITY em um ensaio clínico. Este paciente apresentava níveis de calcitonina pré-tratamento aproximadamente 8 vezes o limite superior do normal (LSN). Um caso adicional de hiperplasia de células C com níveis elevados de calcitonina após o tratamento foi relatado no ensaio de desfechos cardiovasculares (REWIND). Foram relatados casos de CMT em pacientes tratados com liraglutida, outro agonista do receptor GLP-1, no período pós-comercialização; os dados nestes relatórios são insuficientes para estabelecer ou excluir uma relação causal entre o uso de CMT e agonistas do receptor GLP-1 em humanos.
TRULICITY é contra-indicado em pacientes com histórico pessoal ou familiar de CMT ou em pacientes com MEN 2. Aconselhe os pacientes sobre o risco potencial de CMT com o uso de TRULICITY e informe-os sobre sintomas de tumores da tireoide (por exemplo, massa no pescoço, disfagia , dispneia, rouquidão persistente).
O monitoramento de rotina da calcitonina sérica ou o uso de ultrassom da tireoide são de valor incerto para a detecção precoce de CMT em pacientes tratados com TRULICITY. Essa monitorização pode aumentar o risco de procedimentos desnecessários, devido à baixa especificidade do teste para calcitonina sérica e a uma elevada incidência de doença da tiroide. Valores significativamente elevados de calcitonina sérica podem indicar CMT e pacientes com CMT geralmente apresentam valores de calcitonina >50 ng/L. Se a calcitonina sérica for medida e estiver elevada, o paciente deverá ser avaliado posteriormente. Pacientes com nódulos tireoidianos observados no exame físico ou exames de imagem do pescoço também devem ser avaliados posteriormente.
5.2 Pancreatite
Em uma análise agrupada dos estudos de registro originais, 12 (3,4 casos por 1.000 pacientes-ano) reações adversas relacionadas à pancreatite foram relatadas em pacientes expostos ao TRULICITY versus 3 em comparadores não incretinas (2,7 casos por 1.000 pacientes-ano). Uma análise dos eventos adjudicados revelou 5 casos de pancreatite confirmada em pacientes expostos ao TRULICITY (1,4 casos por 1.000 pacientes-ano) versus 1 caso em comparadores sem incretina (0,88 casos por 1.000 pacientes-ano).
Com base em uma análise de eventos adjudicados em um ensaio clínico avaliando Trulicity 1,5 mg, 3 mg ou 4,5 mg uma vez por semana, ocorreu pancreatite em 1 paciente exposto a TRULICITY 1,5 mg (0,2%), em 2 pacientes expostos a TRULICITY 3 mg (0,3 %) e 3 pacientes expostos a TRULICITY 4,5 mg (0,5%).
Após o início de TRULICITY, observe cuidadosamente os pacientes quanto a sinais e sintomas de pancreatite, incluindo dor abdominal intensa e persistente, às vezes com irradiação para as costas, que pode ou não ser acompanhada de vômito. Se houver suspeita de pancreatite, interrompa imediatamente TRULICITY e inicie o tratamento apropriado. Se a pancreatite for confirmada, TRULICITY não deve ser reiniciado. TRULICITY não foi avaliado em pacientes com história prévia de pancreatite. Considere outras terapias antidiabéticas em pacientes com histórico de pancreatite.
5.3 Hipoglicemia com Uso Concomitante de Secretagogos de Insulina ou Insulina
Pacientes recebendo TRULICITY em combinação com um secretagogo de insulina (por exemplo, sulfonilureia) ou insulina podem ter um risco aumentado de hipoglicemia, incluindo hipoglicemia grave.
O risco de hipoglicemia pode ser reduzido por uma redução na dose de sulfonilureia (ou outro secretagogo de insulina administrado concomitantemente) ou insulina. Informe os pacientes que usam esses medicamentos concomitantes sobre o risco de hipoglicemia e eduque-os sobre os sinais e sintomas de hipoglicemia.
5.4 Reações de Hipersensibilidade
Houve relatos pós-comercialização de reações graves de hipersensibilidade, incluindo reações anafiláticas e angioedema em pacientes tratados com TRULICITY. Se ocorrer uma reação de hipersensibilidade, interrompa TRULICITY; trate imediatamente de acordo com o padrão de atendimento e monitore até que os sinais e sintomas desapareçam. TRULICITY está contra-indicado em pacientes com reação grave de hipersensibilidade anterior ao dulaglutido ou a qualquer um dos componentes do TRULICITY.
Anafilaxia e angioedema foram relatados com outros agonistas do receptor GLP-1. Tenha cuidado em um paciente com histórico de angioedema ou anafilaxia com outro agonista do receptor GLP-1 porque não se sabe se esses pacientes estarão predispostos à anafilaxia com TRULICITY.
5.5 Lesão Renal Aguda
Em pacientes tratados com agonistas do receptor GLP-1, incluindo TRULICITY, houve relatos pós-comercialização de insuficiência renal aguda e agravamento da insuficiência renal crônica, que às vezes pode exigir hemodiálise. Alguns destes eventos foram relatados em pacientes sem doença renal subjacente conhecida. A maioria dos eventos relatados ocorreu em pacientes que apresentaram náuseas, vômitos, diarréia ou desidratação. Como essas reações podem piorar a função renal, tenha cuidado ao iniciar ou aumentar as doses de TRULICITY em pacientes com insuficiência renal. Monitorar a função renal em pacientes com insuficiência renal que relatam reações gastrointestinais adversas graves.
5.6 Doença Gastrointestinal Grave
O uso de TRULICITY pode estar associado a reações adversas gastrointestinais, às vezes graves. TRULICITY não foi estudado em pacientes com doença gastrointestinal grave, incluindo gastroparesia grave e, portanto, não é recomendado nestes pacientes.
5.7 Complicações da Retinopatia Diabética em Pacientes com História de Retinopatia Diabética
Em um estudo de resultados cardiovasculares com acompanhamento médio de 5,4 anos envolvendo pacientes com diabetes tipo 2 com doença cardiovascular estabelecida ou múltiplos fatores de risco cardiovascular, ocorreram complicações de retinopatia diabética em pacientes tratados com TRULICITY 1,5 mg (1,9%) e placebo (1,5%) . Esses eventos foram determinados prospectivamente como um desfecho composto secundário. A proporção de pacientes com complicações de retinopatia diabética foi maior entre pacientes com histórico de retinopatia diabética no início do estudo (TRULICITY 8,5%, placebo 6,2%) do que entre pacientes sem histórico conhecido de retinopatia diabética (TRULICITY 1%, placebo 1%).
A rápida melhora no controle da glicose tem sido associada a uma piora temporária da retinopatia diabética. Pacientes com histórico de retinopatia diabética devem ser monitorados quanto à progressão da retinopatia diabética.
5.8 Doença Aguda da Vesícula Biliar
Eventos agudos de doença da vesícula biliar, como colelitíase ou colecistite, foram relatados em ensaios com agonistas do receptor GLP-1 e pós-comercialização. Em um estudo de resultados cardiovasculares com acompanhamento médio de 5,4 anos, a colelitíase ocorreu a uma taxa de 0,62/100 pacientes-ano em pacientes tratados com TRULICITY e 0,56/100 pacientes-ano em pacientes tratados com placebo após ajuste para colecistectomia prévia. Eventos graves de colecistite aguda foram relatados em 0,5% e 0,3% dos pacientes que receberam TRULICITY e placebo, respectivamente. Se houver suspeita de colelitíase, estão indicados estudos da vesícula biliar e acompanhamento clínico apropriado.
6. Reações adversas/efeitos colaterais
As seguintes reações graves são descritas abaixo ou em outras partes das informações de prescrição:
- Risco de tumores de células C da tireoide
- Pancreatite
- Hipoglicemia com uso concomitante de secretagogos de insulina ou insulina
- Reações de hipersensibilidade
- Lesão Renal Aguda
- Doença gastrointestinal grave
- Complicações da retinopatia diabética em pacientes com história de retinopatia diabética
- Doença Aguda da Vesícula Biliar
6.1 Experiência em Ensaios Clínicos
Como os estudos clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser diretamente comparadas com a taxa está nos estudos clínicos de outro medicamento e pode não refletir as taxas observadas na prática.
Reações adversas em ensaios clínicos em adultos com diabetes mellitus tipo 2
Conjunto de ensaios controlados por placebo em adultos para doses de TRULICITY 0,75 mg e 1,5 mg
Os dados na Tabela 1 são derivados de um conjunto de ensaios controlados por placebo e incluem 1.670 pacientes adultos com diabetes mellitus tipo 2 expostos ao TRULICITY com uma duração média de exposição de 23,8 semanas. A idade média dos pacientes foi de 56 anos, 1% tinha 75 anos ou mais e 53% eram do sexo masculino. A população era 69% branca, 7% negra ou afro-americana, 13% asiática; 30% eram de etnia hispânica ou latina. No início do estudo, a população tinha diabetes há uma média de 8 anos, uma HbA1c média de 8,0% e 2,5% da população relatou retinopatia. A função renal estimada no início do estudo era normal ou levemente prejudicada (TFGe ≥60 mL/min/1,73 m2) em 96%.
A Tabela 1 mostra as reações adversas, excluindo hipoglicemia, ocorrendo em ≥5% dos pacientes adultos tratados com TRULICITY e mais comumente que o placebo em um conjunto de ensaios controlados por placebo.
| a Inclui diarreia, aumento do volume fecal, evacuações frequentes. | |||
| b Inclui ânsia de vômito, vômito, projétil de vômito. | |||
| c Inclui desconforto abdominal, dor abdominal, dor abdominal inferior, dor abdominal superior, sensibilidade abdominal, dor gastrointestinal. | |||
| d Inclui fadiga, astenia, mal-estar. | |||
| Nota: As porcentagens refletem o número de pacientes que relataram pelo menos 1 ocorrência da reação adversa emergente do tratamento. | |||
| Reação adversa | Placebo (N=568) % |
TRULICIDADE 0,75 mg (N=836) % |
TRULICIDADE 1,5 mg (N=834) % |
| Náusea | 5.3 | 12.4 | 21.1 |
| Diarréiaa | 6.7 | 8,9 | 12.6 |
| Vômitob | 2.3 | 6,0 | 12,7 |
| Dor abdominalc | 4.9 | 6,5 | 9.4 |
| Diminuição do apetite | 1.6 | 4.9 | 8.6 |
| Dispepsia | 2.3 | 4.1 | 5.8 |
| Fadigad | 2.6 | 4.2 | 5.6 |
Reações adversas gastrointestinais
No conjunto de ensaios controlados por placebo, as reações adversas gastrointestinais (GI) ocorreram com mais frequência entre os pacientes que receberam TRULICITY em comparação com os pacientes que receberam placebo (placebo 21%, 0,75 mg 32%, 1,5 mg 41%). Uma porcentagem maior de pacientes que receberam TRULICITY 0,75 mg (1,3%) e TRULICITY 1,5 mg (3,5%) descontinuaram o tratamento devido a reações adversas gastrointestinais do que pacientes que receberam placebo (0,2%). Os investigadores classificaram a gravidade das reações adversas gastrointestinais que ocorreram naqueles tratados com 0,75 mg e 1,5 mg de TRULICITY como “leves” em 58% e 48% dos casos, respectivamente, “moderados” em 35% e 42% dos casos, respectivamente, ou “grave” em 7% e 11% dos casos, respectivamente.
As seguintes reações adversas gastrointestinais foram relatadas com mais frequência em pacientes tratados com TRULICITY do que em pacientes tratados com placebo (frequências listadas, respectivamente, como: placebo; 0,75 mg; 1,5 mg): constipação (0,7%, 3,9%, 3,7%), flatulência ( 1,4%, 1,4%, 3,4%), distensão abdominal (0,7%, 2,9%, 2,3%), doença do refluxo gastroesofágico (0,5%, 1,7%, 2,0%) e eructação (0,2%, 0,6%, 1,6%).
Ensaio de variação de dose em adultos para doses de TRULICITY 3 mg e 4,5 mg
A Tabela 2 mostra as reações adversas que ocorreram ≥5% em qualquer um dos grupos de tratamento ao longo de 36 semanas em um ensaio clínico com 1.842 pacientes adultos com diabetes mellitus tipo 2 tratados com TRULICITY 1,5 mg, 3 mg ou 4,5 mg por via subcutânea uma vez por semana como suplemento. para metformina. O perfil de reações adversas é consistente com ensaios clínicos anteriores em adultos.
| a As porcentagens refletem o número de pacientes que relataram pelo menos 1 ocorrência da reação adversa emergente do tratamento. | |||
| Reação adversa | TRULICIDADE 1,5 mg (N=612) % |
TRULICIDADE 3 mg (N=616) % |
TRULICIDADE 4,5 mg (N=614) % |
| Náusea | 13.4 | 15.6 | 16.4 |
| Diarréia | 7,0 | 11.4 | 10.7 |
| Vômito | 5.6 | 8.3 | 9.3 |
| Dispepsia | 2.8 | 5,0 | 2.6 |
Outras reações adversas em adultos
Hipoglicemia
A Tabela 3 resume a incidência de hipoglicemia nos estudos clínicos controlados por placebo em pacientes adultos com diabetes mellitus tipo 2: episódios com nível de glicose <54 mg/dL com ou sem sintomas, e hipoglicemia grave, definida como um episódio que requer assistência de outra pessoa administre ativamente carboidratos, glucagon ou outras ações de ressuscitação.
| Placebo | TRULICIDADE 0,75 mg | TRULICIDADE 1,5 mg | |
| Complemento da metformina | |||
| (26 semanas) | N=177 | N=302 | N=304 |
| Hipoglicemia com nível de glicose <54mg/dL |
0 | 0,3 | 0,7 |
| Hipoglicemia grave | 0 | 0 | 0 |
| Complemento de Metformina + Pioglitazona | |||
| (26 semanas) | N=141 | N=280 | N=279 |
| Hipoglicemia com nível de glicose <54 mg/dL |
1.4 | 2.1 | 0 |
| Hipoglicemia grave | 0 | 0 | 0 |
| Complemento da Glimepirida | |||
| (24 semanas) | N=60 | – | N=239 |
| Hipoglicemia com nível de glicose <54 mg/dL |
0 | – | 3.3 |
| Hipoglicemia grave | 0 | – | 0 |
| Em combinação com insulina glargina ± metformina | |||
| (28 semanas) | N=150 | – | N=150 |
| Hipoglicemia com nível de glicose <54 mg/dL |
9.3 | – | 14,7 |
| Hipoglicemia grave | 0 | – | 0,7 |
| Complemento para SGLT2i ± Metformina | |||
| (24 semanas) | N=140 | N=141 | N=142 |
| Hipoglicemia com nível de glicose <54 mg/dL |
0,7 | 0,7 | 0,7 |
| Hipoglicemia grave | 0 | 0,7 | 0 |
A hipoglicemia foi mais frequente quando TRULICITY foi usado em combinação com uma sulfonilureia ou insulina do que quando usado com não secretagogos. Em um ensaio clínico em adultos de 78 semanas, ocorreu hipoglicemia (nível de glicose <54 mg/dL) em 20% e 21% dos pacientes quando TRULICITY 0,75 mg e 1,5 mg, respectivamente, foram coadministrados com uma sulfonilureia. Ocorreu hipoglicemia grave em 0% e 0,7% dos pacientes quando TRULICITY 0,75 mg e 1,5 mg, respectivamente, foram coadministrados com uma sulfonilureia. Em um ensaio clínico em adultos de 52 semanas, ocorreu hipoglicemia (nível de glicose <54 mg/dL) em 77% e 69% dos pacientes quando TRULICITY 0,75 mg e 1,5 mg, respectivamente, foram coadministrados com insulina prandial. Ocorreu hipoglicemia grave em 2,7% e 3,4% dos pacientes quando TRULICITY 0,75 mg e 1,5 mg, respectivamente, foram coadministrados com insulina prandial. Consulte a Tabela 3 para a incidência de hipoglicemia em pacientes tratados em combinação com insulina glargina basal.
No ensaio clínico com pacientes adultos recebendo TRULICITY 1,5 mg, TRULICITY 3 mg ou TRULICITY 4,5 mg uma vez por semana, como complemento à metformina, as incidências de hipoglicemia (nível de glicose <54 mg/dL) ao longo de 36 semanas foram de 1,1%, 0,3 % e 1,1%, respectivamente, e as incidências de hipoglicemia grave foram de 0,2%, 0% e 0,2%, respectivamente.
Colelitíase e colecistite
Em um estudo de desfechos cardiovasculares em pacientes adultos com diabetes mellitus tipo 2 e doença cardiovascular (CV) estabelecida ou múltiplos fatores de risco cardiovascular com acompanhamento médio de 5,4 anos, a colelitíase ocorreu a uma taxa de 0,62/100 pacientes-ano em pacientes tratados com TRULICITY e 0,56/100 pacientes-ano em pacientes tratados com placebo após ajuste para colecistectomia prévia. Eventos graves de colecistite aguda foram relatados em 0,5% e 0,3% dos pacientes que receberam TRULICITY e placebo, respectivamente.
Aumento da frequência cardíaca e reações adversas relacionadas à taquicardia
Em pacientes adultos, TRULICITY 0,75 mg e 1,5 mg resultou em um aumento médio na frequência cardíaca (FC) de 2-4 batimentos por minuto (bpm).
Reações adversas de taquicardia sinusal foram relatadas com mais frequência em pacientes expostos ao TRULICITY. Taquicardia sinusal foi relatada em 3,0%, 2,8% e 5,6% dos pacientes tratados com placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente. A persistência de taquicardia sinusal (relatada em mais de 2 visitas) foi relatada em 0,2%, 0,4% e 1,6% dos pacientes tratados com placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente. Episódios de taquicardia sinusal, associados a um aumento concomitante da frequência cardíaca basal de ≥15 batimentos por minuto, foram relatados em 0,7%, 1,3% e 2,2% dos pacientes tratados com placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente.
Hipersensibilidade
Reações adversas de hipersensibilidade sistêmica, às vezes graves (por exemplo, urticária grave, erupção cutânea sistêmica, edema facial, inchaço dos lábios), ocorreram em 0,5% dos pacientes adultos que receberam TRULICITY em estudos clínicos.
Reações no local da injeção
Nos estudos controlados por placebo em adultos, foram relatadas reações no local da injeção (por exemplo, erupção cutânea no local da injeção, eritema) em 0,5% dos pacientes tratados com TRULICITY e em 0,0% dos pacientes tratados com placebo.
Prolongamento do intervalo PR e reações adversas do bloqueio atrioventricular (AV) de primeiro grau
Um aumento médio desde o início do intervalo PR de 2-3 milissegundos foi observado em pacientes adultos tratados com TRULICITY, em contraste com uma diminuição média de 0,9 milissegundos em pacientes tratados com placebo. A reação adversa de bloqueio AV de primeiro grau ocorreu mais frequentemente em pacientes tratados com TRULICITY do que com placebo (0,9%, 1,7% e 2,3% para placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente). Nos eletrocardiogramas, um aumento do intervalo PR para pelo menos 220 milissegundos foi observado em 0,7%, 2,5% e 3,2% dos pacientes tratados com placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente.
Aumento de Amilase e Lipase
Pacientes adultos expostos ao TRULICITY tiveram aumentos médios desde o início da lipase e/ou amilase pancreática de 14% a 20%, enquanto os pacientes tratados com placebo tiveram aumentos médios de até 3%.
Reações adversas no ensaio clínico de pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2
TRULICITY foi administrado a 150 pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2 por uma duração média de 41,3 semanas[[veja Estudos Clínicos (14.6)]. A média de idade foi de 14,5 anos e 71% dos pacientes eram do sexo feminino. No geral, 55% eram brancos, 15% eram negros ou afro-americanos, 12% eram asiáticos, 10% eram índios americanos ou nativos do Alasca, 5% eram de outras raças e 3% tinham raça desconhecida. Além disso, 55% eram hispânicos ou latinos, 42% não eram hispânicos ou latinos e 3% tinham etnia desconhecida. No início do estudo, a duração média do diabetes mellitus tipo 2 foi de 2 anos, a HbA1c média foi de 8,1%, o peso médio foi de 90,5 kg e o IMC médio foi de 34,1 kg/m2.
O perfil de segurança em pacientes pediátricos tratados com TRULICITY 0,75 mg e 1,5 mg por via subcutânea uma vez por semana foi consistente com o descrito acima para pacientes adultos com diabetes mellitus tipo 2, com exceção das reações no local da injeção. Em pat pediátrico pacientes, a incidência de reações no local da injeção foi de 3,9% (2 pacientes) no grupo TRULICITY 0,75 mg, 3,8% (2 pacientes) no grupo TRULICITY 1,5 mg e 2,0% (1 paciente) no grupo placebo.
6.2 Experiência pós-comercialização
As seguintes reações adversas adicionais foram relatadas durante o uso pós-aprovação de TRULICITY. Como esses eventos são relatados voluntariamente por uma população de tamanho incerto, geralmente não é possível estimar com segurança a sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
- Gastrointestinal: íleo
- Hepatobiliar: colecistite, colelitíase que requer colecistectomia, colestase, elevação das enzimas hepáticas, hepatite
- Hipersensibilidade: reações anafiláticas, angioedema
- Renal: insuficiência renal aguda ou agravamento da insuficiência renal crónica, por vezes necessitando de hemodiálise
7. Interações medicamentosas
7.1 Medicamentos orais
TRULICITY atrasa o esvaziamento gástrico e, portanto, tem o potencial de reduzir a taxa de absorção de medicamentos orais administrados concomitantemente. O atraso no esvaziamento gástrico depende da dose, mas é atenuado com o aumento da dose recomendado para doses mais altas de TRULICITY. O atraso é maior após a primeira dose e diminui com as doses subsequentes. Em estudos de farmacologia clínica, TRULICITY 1,5 mg não afetou a absorção dos medicamentos administrados por via oral testados em um grau clinicamente relevante. A experiência com o uso de medicamentos concomitantes em ensaios clínicos com doses de TRULICITY de 3 mg e 4,5 mg é limitada.
Monitore os níveis de medicamentos orais com índice terapêutico estreito (por exemplo, varfarina) quando administrados concomitantemente com TRULICITY.
7.2 Uso concomitante com um secretagogo de insulina (por exemplo, sulfonilureia) ou com insulina
Ao iniciar TRULICITY, considere reduzir a dose de secretagogos de insulina administrados concomitantemente (como sulfonilureias) ou insulina para reduzir o risco de hipoglicemia.
8. Uso em populações específicas
8.1 Gravidez
Resumo de riscos
Dados limitados com TRULICITY em mulheres grávidas não são suficientes para determinar um risco associado ao medicamento para defeitos congênitos graves e aborto espontâneo. Existem considerações clínicas sobre os riscos de diabetes mal controlado na gravidez. Com base em estudos de reprodução animal, pode haver riscos para o feto devido à exposição ao dulaglutido durante a gravidez. TRULICITY deve ser usado durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Em ratas grávidas às quais foi administrado dulaglutido durante a organogénese, ocorreram mortes embrionárias precoces, reduções no crescimento fetal e anomalias fetais com exposições sistémicas pelo menos 6 vezes a exposição humana na dose humana máxima recomendada (MRHD) de 4,5 mg/semana. Em coelhas grávidas às quais foi administrado dulaglutido durante a organogénese, ocorreram anomalias fetais importantes com 5 vezes a exposição humana no MRHD. Os efeitos adversos embrio/fetais em animais ocorreram em associação com a diminuição do peso materno e do consumo de alimentos atribuídos à farmacologia do dulaglutido.
O risco de fundo estimado de defeitos congênitos graves é de 6–10% em mulheres com diabetes pré-gestacional com HbA1c >7% e tem sido relatado como sendo tão alto quanto 20–25% em mulheres com HbA1c >10%. O risco de base estimado de aborto espontâneo para a população indicada é desconhecido. Na população geral dos EUA, o risco estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2–4% e 15–20%, respectivamente.
Considerações Clínicas
Risco materno e/ou embrio/fetal associado a doenças
O diabetes mal controlado na gravidez aumenta o risco materno de cetoacidose diabética, pré-eclâmpsia, abortos espontâneos, parto prematuro e complicações no parto. O diabetes mal controlado aumenta o risco fetal de defeitos congênitos graves, natimortos e morbidade relacionada à macrossomia.
Dados
Dados de animais
Ratas grávidas que receberam doses subcutâneas de 0,49, 1,63 ou 4,89 mg/kg de dulaglutida a cada 3 dias durante a organogênese tiveram exposições sistêmicas 2, 6 e 18 vezes a exposição humana na dose humana máxima recomendada (MRHD) de 4,5 mg/semana , respectivamente, com base na comparação da área plasmática sob a curva tempo-concentração (AUC). A redução do peso fetal associada à diminuição da ingestão alimentar materna e à diminuição do ganho de peso atribuído à farmacologia do dulaglutido foi observada em ≥1,63 mg/kg. Ossificações esqueléticas irregulares e aumentos na perda pós-implantação também foram observados com 4,89 mg/kg.
Em coelhas prenhes que receberam doses subcutâneas de 0,04, 0,12 ou 0,41 mg/kg de dulaglutida a cada 3 dias durante a organogênese, as exposições sistêmicas em coelhas prenhes foram de 0,5, 2 e 5 vezes a exposição humana no MRHD, com base na comparação da AUC plasmática . Foram observadas malformações viscerais fetais de agenesia lobular pulmonar e malformações esqueléticas das vértebras e/ou costelas em conjunto com diminuição da ingestão alimentar materna e diminuição do ganho de peso atribuído à farmacologia do dulaglutido a 0,41 mg/kg.
Em um estudo pré-natal-pós-natal em F0 ratas maternas que receberam doses subcutâneas de 0,2, 0,49 ou 1,63 mg/kg a cada três dias desde a implantação até a lactação, as exposições sistêmicas em ratas grávidas foram 1, 2 e 7 vezes a exposição humana no MRHD, com base na comparação da AUC plasmática . F1 filhotes de F0 ratos maternos que receberam 1,63 mg / kg de dulaglutido tiveram peso corporal médio estatisticamente significativamente menor desde o nascimento até o dia pós-natal 63 para machos e dia pós-natal 84 para fêmeas. F1 descendência de F0 os ratos maternos que receberam 1,63 mg/kg de dulaglutido apresentaram diminuição da força de preensão dos membros anteriores e posteriores e os machos apresentaram atraso na separação balano-prepucial. As fêmeas diminuíram a resposta de sobressalto. Estas descobertas físicas podem estar relacionadas com a diminuição do tamanho da prole em relação aos controlos, uma vez que apareceram nas primeiras avaliações pós-natais, mas não foram observadas numa avaliação posterior. F1 descendência feminina do F0 ratos maternos que receberam 1,63 mg/kg de dulaglutida tiveram um tempo médio de escape mais longo e um número médio mais alto de erros em relação ao controle simultâneo durante 1 de 2 ensaios na porção de avaliação da memória do labirinto aquático de Biel. Esses achados ocorreram em conjunto com a diminuição do F0 ingestão alimentar materna e diminuição do ganho de peso atribuído à atividade farmacológica de 1,63 mg/kg. A relevância humana desses déficits de memória no F1 ratas fêmeas não é conhecida.
8.2 Lactação
Resumo de riscos
Não existem dados sobre a presença de dulaglutida no leite humano, os efeitos no lactente ou na produção de leite. A presença de dulaglutido no leite de animais lactantes tratados não foi determinada. Os benefícios da amamentação para o desenvolvimento e a saúde devem ser considerados juntamente com a necessidade clínica da mãe de TRULICITY e quaisquer efeitos adversos potenciais sobre o bebê amamentado devido ao TRULICITY ou à condição materna subjacente.
8.4 Uso Pediátrico
A segurança e eficácia de TRULICITY como complemento à dieta e exercício para melhorar o controle glicêmico em pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2 foram estabelecidas. O uso de TRULICITY para esta indicação é apoiado por um estudo de 26 semanas, multicêntrico, randomizado, duplo-cego, de braço paralelo, controlado por placebo em 154 pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2.
Pacientes pediátricos tratados com TRULICITY relataram uma incidência maior de reações relacionadas ao local da injeção em comparação com adultos tratados com TRULICITY.
A segurança e eficácia de TRULICITY não foram estabelecidas em pacientes pediátricos com menos de 10 anos de idade.
8.5 Uso Geriátrico
Nos ensaios de controle glicêmico em adultos, 620 (19%) dos pacientes tratados com TRULICITY tinham 65 anos de idade ou mais e 65 (2%) dos pacientes tratados com TRULICITY tinham 75 anos de idade ou mais no início do estudo. No braço de tratamento TRULICITY 1,5 mg do estudo REWIND (ensaio de resultados cardiovasculares em adultos com diabetes mellitus tipo 2 e doença cardiovascular ou múltiplos fatores de risco cardiovascular).619 (53%) pacientes tinham 65 anos de idade ou mais e 484 (10%) pacientes tinham 75 anos de idade ou mais no início do estudo.
Não foram observadas diferenças gerais na segurança ou eficácia de TRULICITY entre pacientes com 65 anos de idade ou mais e pacientes adultos mais jovens.
8.6 Insuficiência Renal
TRULICITY foi estudado em pacientes com vários graus de função renal, incluindo um ensaio clínico dedicado em pacientes com doença renal crônica moderada a grave. Não foram observadas diferenças globais na segurança ou eficácia nestes estudos de acordo com a função renal.
Num estudo de farmacologia clínica em doentes com compromisso renal, incluindo doença renal terminal (DRT), não foram observadas alterações clinicamente relevantes na farmacocinética (PK) do dulaglutido. No ensaio de 52 semanas em pacientes com diabetes tipo 2 e insuficiência renal moderada a grave, o comportamento farmacocinético de TRULICITY 0,75 mg e 1,5 mg uma vez por semana foi semelhante ao demonstrado em estudos clínicos anteriores.
Nenhum ajuste de dose é recomendado em pacientes com insuficiência renal, incluindo doença renal em estágio terminal (DRT). Monitore a função renal em pacientes com insuficiência renal que relatam reações gastrointestinais adversas graves. Use TRULICITY com cautela em pacientes com doença renal terminal.
8.7 Insuficiência Hepática
Num estudo de farmacologia clínica em doentes com vários graus de compromisso hepático, não foi observada qualquer alteração clinicamente relevante na farmacocinética do dulaglutido. Contudo, a experiência clínica em doentes com compromisso hepático ligeiro, moderado ou grave é limitada; portanto, use TRULICITY com cautela nessas populações de pacientes.
8.8 Gastroparesia
Dulaglutida retarda o esvaziamento gástrico. TRULICITY não foi estudado em pacientes com gastroparesia preexistente. Use TRULICITY com cautela em pacientes com gastroparesia.
10. Sobredosagem
Sobredosagens foram relatadas em estudos clínicos. Os efeitos associados a estas sobredosagens foram principalmente acontecimentos gastrointestinais ligeiros ou moderados (por exemplo, náuseas, vómitos) e hipoglicemia não grave. Em caso de sobredosagem, devem ser iniciados cuidados de suporte adequados (incluindo monitorização frequente da glicose plasmática) de acordo com os sinais e sintomas clínicos do doente.
11. Descrição da Trulicidade
Dulaglutida é um agonista do receptor do peptídeo 1 semelhante ao glucagon humano (GLP-1). A molécula é uma proteína de fusão que consiste em 2 cadeias idênticas ligadas por dissulfeto, cada uma contendo uma sequência análoga de GLP-1 N-terminal ligada covalentemente à porção Fc de uma cadeia pesada de imunoglobulina humana G4 (IgG4) modificada por um pequeno ligante peptídico. e é produzido usando cultura de células de mamíferos (ovário de hamster chinês). A porção análoga do GLP-1 da dulaglutida é 90% homóloga ao GLP-1 humano nativo (7-37). Modificações estruturais foram introduzidas na parte GLP-1 da molécula responsável pela interação com a enzima dipeptidil-peptidase-IV (DPP-4). Modificações adicionais foram feitas em uma área com um potencial epítopo de células T e nas áreas da parte IgG4 Fc da molécula responsável pela ligação aos receptores Fc de alta afinidade e pela formação de meio anticorpo. O peso molecular total da dulaglutida é de aproximadamente 63 quilodaltons.
A injeção de TRULICITY (dulaglutida) é uma solução límpida, incolor, estéril e sem conservantes para uso subcutâneo. Cada caneta unidose contém 0,5 mL de solução de 0,75 mg, 1,5 mg, 3 mg ou 4,5 mg de dulaglutida e os seguintes excipientes: ácido cítrico anidro (0,07 mg), manitol (23,2 mg), polissorbato 80 (0,10 mg para 0,75 mg e 1,5 mg; 0,125 mg para 3 mg e 4,5 mg) e citrato trissódico di-hidratado (1,37 mg), em água para preparações injetáveis.
12. Trulicitidade – Farmacologia Clínica
12.1 Mecanismo de Ação
TRULICITY contém dulaglutida, que é um agonista do receptor GLP-1 humano com 90% de homologia de sequência de aminoácidos com GLP-1 humano endógeno (7-37). A dulaglutida ativa o receptor GLP-1, um receptor de superfície celular ligado à membrana receptor acoplado à adenilil ciclase nas células beta pancreáticas. A dulaglutida aumenta o AMP cíclico intracelular (cAMP) nas células beta, levando à liberação de insulina dependente da glicose. A dulaglutida também diminui a secreção de glucagon e retarda o esvaziamento gástrico.
12.2 Farmacodinâmica
TRULICITY reduz a glicemia de jejum e reduz as concentrações de glicose pós-prandial (PPG) em pacientes com diabetes mellitus tipo 2. A redução da glicemia de jejum e pós-prandial pode ser observada após dose única.
Glicose de jejum e pós-prandial
Em um estudo de farmacologia clínica em pacientes com diabetes mellitus tipo 2, o tratamento com TRULICITY uma vez por semana resultou em uma redução das concentrações de PPG em jejum e de 2 horas, e na AUC incremental da glicose sérica pós-prandial, quando comparado ao placebo (-25,6 mg/dL, – 59,5 mg/dL e -197 mg*h/dL, respectivamente); estes efeitos foram mantidos após 6 semanas de administração da dose de 1,5 mg.
Secreção de insulina de primeira e segunda fase
A secreção de insulina na primeira e na segunda fase aumentou em pacientes com diabetes tipo 2 tratados com TRULICITY em comparação com placebo.
Secreção de insulina e glucagon
TRULICITY estimula a secreção de insulina dependente de glicose e reduz a secreção de glucagon. O tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana aumentou a insulina em jejum desde o valor basal na semana 26 em 35,38 e 17,50 pmol/L, respectivamente, e a concentração de peptídeo C em 0,09 e 0,07 nmol/L, respectivamente, em um ensaio de monoterapia. No mesmo ensaio, a concentração de glucagon em jejum foi reduzida em 1,71 e 2,05 pmol/L em relação ao valor basal com TRULICITY 0,75 mg e 1,5 mg, respectivamente.
Motilidade Gástrica
A dulaglutida causa um atraso no esvaziamento gástrico. O atraso no esvaziamento gástrico depende da dose, mas é atenuado com o aumento adequado da dose para doses mais altas de TRULICITY. O atraso é maior após a primeira dose e diminui com as doses subsequentes.
Eletrofisiologia Cardíaca (QTc)
O efeito do dulaglutido na repolarização cardíaca foi testado num estudo completo do QTc. A dulaglutida não produziu prolongamento do intervalo QTc nas doses de 4 e 7 mg. A dose máxima recomendada é de 4,5 mg uma vez por semana.
12.3 Farmacocinética
A farmacocinética do dulaglutido é semelhante entre indivíduos saudáveis e doentes com diabetes mellitus tipo 2. Após administração subcutânea, o tempo até à concentração plasmática máxima de dulaglutido no estado estacionário varia entre 24 e 72 horas, com uma mediana de 48 horas. Depois de atingir o estado estacionário, a razão de acumulação foi de aproximadamente 1,56. As concentrações plasmáticas de dulaglutido no estado estacionário foram alcançadas entre 2 e 4 semanas após a administração uma vez por semana. O local da administração subcutânea (abdômen, braço e coxa) não teve efeito estatisticamente significativo na exposição ao dulaglutido.
Absorção – A biodisponibilidade média absoluta do dulaglutido após administração subcutânea de doses únicas de 0,75 mg e 1,5 mg foi de 65% e 47%, respetivamente. A biodisponibilidade subcutânea absoluta para doses de 3 mg e 4,5 mg foi estimada como sendo semelhante a 1,5 mg, embora isto não tenha sido especificamente estudado. As concentrações de dulaglutido aumentaram aproximadamente proporcionalmente à dose de 0,75 mg para 4,5 mg.
Distribuição – O volume de distribuição central médio da população aparente foi de 3,09 L e o volume de distribuição periférico médio da população aparente foi de 5,98 L.
Eliminação
A depuração média populacional aparente do dulaglutido foi de 0,142 l/h. A meia-vida de eliminação da dulaglutida foi de aproximadamente 5 dias.
Metabolismo – Presume-se que o dulaglutido é degradado nos seus aminoácidos componentes pelas vias gerais de catabolismo proteico.
Populações Específicas
Os fatores intrínsecos de idade (≥ 65 anos), sexo, raça, etnia, peso corporal ou compromisso renal ou hepático não tiveram um efeito clinicamente relevante na farmacocinética do dulaglutido, como mostrado na Figura 1.
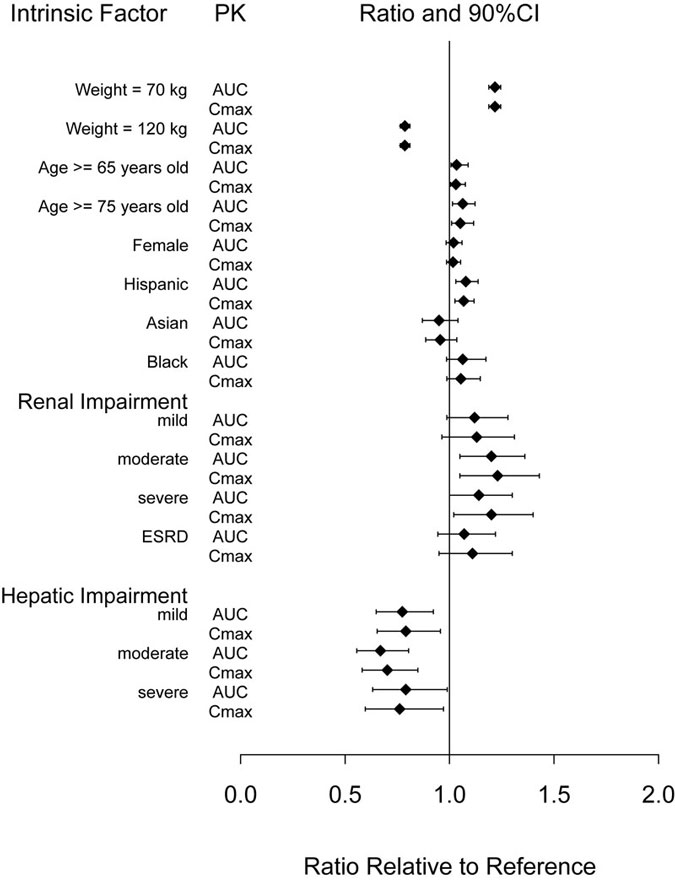
Abreviaturas: AUC = área sob a curva tempo-concentração; IC = intervalo de confiança; Cmáx. = concentração máxima; DRT = doença renal terminal; PK = farmacocinética.
Nota: Os valores de referência para comparações de peso, idade, sexo e raça são 93 kg, 56 anos, sexo masculino e branco, respectivamente; os grupos de referência para dados de insuficiência renal e hepática são indivíduos com função renal e hepática normais nos respectivos estudos de farmacologia clínica. Os valores de peso mostrados no gráfico (70 e 120 kg) são os 10º e 90º percentis de peso na população PK.
Figura 1: Impacto dos fatores intrínsecos na farmacocinética do dulaglutido.
Pacientes Pediátricos
Foi realizada uma análise farmacocinética populacional para dulaglutida 0,75 mg e 1,5 mg utilizando dados de 128 pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2. A AUC em pacientes pediátricos foi aproximadamente 37% menor que em pacientes adultos. No entanto, esta diferença não foi determinada como clinicamente significativa.
Pacientes com Insuficiência Renal
A exposição sistémica ao dulaglutido aumentou 20, 28, 14 e 12% para os subgrupos de compromisso renal ligeiro, moderado, grave e DRT, respetivamente, em comparação com indivíduos com função renal normal. Os valores correspondentes para aumento em Cmáx. foram 13, 23, 20 e 11%, respectivamente (Figura 1). Além disso, num ensaio clínico de 52 semanas em pacientes com diabetes mellitus tipo 2 e insuficiência renal moderada a grave, o comportamento farmacocinético de TRULICITY 0,75 mg e 1,5 mg uma vez por semana foi semelhante ao demonstrado em estudos clínicos anteriores.
Pacientes com insuficiência hepática
A exposição sistémica ao dulaglutido diminuiu 23, 33 e 21% para os grupos de compromisso hepático ligeiro, moderado e grave, respetivamente, em comparação com indivíduos com função hepática normal, e Cmáx. diminuiu em uma magnitude semelhante (Figura 1).
Estudos de interação medicamentosa
O efeito potencial de medicamentos coadministrados na farmacocinética de dulaglutida 1,5 mg e vice-versa foi estudado em vários estudos de dose única e múltipla em indivíduos saudáveis, pacientes com diabetes mellitus tipo 2 e pacientes com hipertensão.
Potencial para Dulaglutida influenciar a farmacocinética de outras drogas
A dulaglutida retarda o esvaziamento gástrico e, como resultado, pode reduzir a extensão e a taxa de absorção de medicamentos coadministrados por via oral. Em estudos de farmacologia clínica, o dulaglutido numa dose de 1,5 mg não afetou a absorção dos medicamentos administrados por via oral testados em qualquer grau clinicamente relevante. O atraso no esvaziamento gástrico depende da dose, mas é atenuado com o aumento da dose recomendado para doses mais altas de TRULICITY. O atraso é maior após a primeira dose e diminui com as doses subsequentes. As medidas PK que indicam a magnitude dessas interações são apresentadas na Figura 2.
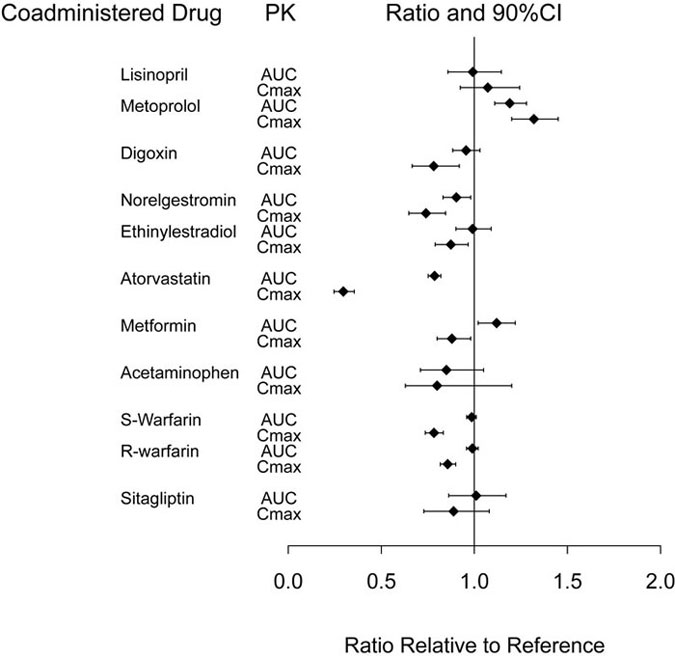
Abreviaturas: AUC = área sob a curva tempo-concentração; IC = intervalo de confiança; Cmáx. = concentração máxima; PK = farmacocinética.
Nota: O grupo de referência é um medicamento coadministrado administrado isoladamente.
Figura 2: Impacto do dulaglutido 1,5 mg na farmacocinética de medicamentos coadministrados.
Potencial para medicamentos coadministrados influenciarem a farmacocinética da dulaglutida
Num estudo de farmacologia clínica, a administração concomitante de uma dose única de 1,5 mg de dulaglutido com uma dose no estado estacionário de 100 mg de sitagliptina causou um aumento na AUC e C do dulaglutido. máx. de aproximadamente 38% e 27%, o que não é considerado clinicamente relevante.
12.6 Imunogenicidade
A incidência observada de anticorpos antidrogas é altamente dependente da sensibilidade e especificidade do ensaio. As diferenças nos métodos de ensaio impedem comparações significativas da incidência de anticorpos antifármacos nos estudos descritos abaixo com a incidência de anticorpos antifármacos noutros estudos.
Em ensaios de controle glicêmico em adultos com diabetes mellitus tipo 2 (monoterapia e terapia combinada), durante um período de tratamento variando de 24 a 104 semanas, 64/3.907 (1,6%) dos pacientes tratados com TRULICITY desenvolveram anticorpos antidulaglutida (referidos como anticorpos antidrogas (ADA)). Dos 64 pacientes tratados com TRULICITY que desenvolveram ADA, 34 pacientes (0,9% da população geral) desenvolveram anticorpos neutralizantes de dulaglutida e 36 pacientes (0,9% da população geral) desenvolveram anticorpos contra GLP-1 nativo. Não foi identificado nenhum efeito clinicamente significativo do ADA na farmacocinética, farmacodinâmica, segurança ou eficácia do TRULICITY durante a duração do tratamento de 24 a 104 semanas nos ensaios em adultos com diabetes mellitus tipo 2.
Durante o período controlado de 26 semanas do ensaio de controle glicêmico em pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2, 4/101 (4%) dos pacientes pediátricos tratados com TRULICITY desenvolveram ADA. Dos 4 pacientes pediátricos que desenvolveram ADA, 1 paciente (1% da população total) desenvolveu anticorpos neutralizantes da dulaglutida e 3 pacientes (3% da população total) desenvolveram anticorpos contra GLP-1 nativo. Durante o período pós-base de 52 semanas do mesmo estudo (por meio de acompanhamento de segurança), 6/103 (6%) dos pacientes tratados com TRULICITY desenvolveram ADA. Dos 6 pacientes que desenvolveram ADA, 1 paciente (1% da população total) desenvolveu anticorpos neutralizantes da dulaglutida e 4 pacientes (4% da população total) desenvolveram anticorpos contra o GLP-1 nativo. Devido à baixa ocorrência de ADA, o efeito desses anticorpos na farmacocinética, farmacodinâmica, segurança e/ou eficácia de TRULICITY é desconhecido em pacientes pediátricos.
13. Toxicologia Não Clínica
13.1 Carcinogênese, Mutagênese e Prejuízo da Fertilidade
Um estudo de carcinogenicidade de 2 anos foi conduzido com dulaglutida em ratos machos e fêmeas em doses de 0,05, 0,5, 1,5 e 5 mg/kg (0,2, 3, 8 e 24 vezes o MRHD de 4,5 mg uma vez por semana com base na AUC) administrado por injeção subcutânea duas vezes por semana. Em ratos, o dulaglutido causou um aumento relacionado com a dose e dependente da duração do tratamento na incidência de tumores das células C da tiróide (adenomas e/ou carcinomas) em comparação com os controlos, ≥3 vezes o MRHD com base na AUC. Foi observado um aumento estatisticamente significativo nos adenomas de células C em ratos que receberam dulaglutido ≥0,5 mg/kg. Aumentos numéricos nos carcinomas de células C da tireoide ocorreram com 5 mg/kg (24 vezes o MRHD com base na AUC) e foram considerados relacionados ao tratamento, apesar da ausência de significância estatística.
Um estudo de carcinogenicidade de 6 meses foi realizado com dulaglutida em camundongos transgênicos rasH2 em doses de 0,3, 1 e 3 mg/kg administradas por injeção subcutânea duas vezes por semana. Dulaglutida não produziu aumento na incidência de hiperplasia ou neoplasia de células C da tireoide em qualquer dose.
Dulaglutida é uma proteína recombinante; não foram realizados estudos de genotoxicidade.
A relevância humana dos tumores de células C da tireoide em ratos é desconhecida e não pôde ser determinada por estudos clínicos ou não clínicos .
Em estudos de fertilidade e desenvolvimento embrionário inicial em ratos machos e fêmeas, não foram observados efeitos adversos do dulaglutido na morfologia do esperma, no acasalamento, na fertilidade, na concepção e na sobrevivência embrionária até 16,3 mg/kg (55 vezes a MRHD com base na AUC) . Em ratas fêmeas, foi observado um aumento no número de fêmeas com diestro prolongado e uma diminuição relacionada à dose no número médio de corpos lúteos, locais de implantação e embriões viáveis com ≥4,9 mg/kg (≥13 vezes o MRHD com base na AUC), que ocorreu na presença de diminuição do consumo alimentar materno e ganho de peso corporal.
13.2 Toxicologia e/ou Farmacologia Animal
Ratos gordurosos diabéticos Zucker (ZDF) receberam 0,5, 1,5 ou 5 mg/kg/dulaglutida duas vezes por semana (1, 3 e 13 vezes o MRHD com base na AUC) durante 3 meses. Aumentos de 12% a 33% na amilase total e pancreática, mas não na lipase, foram observados em todas as doses, sem correlações inflamatórias pancreáticas microscópicas em animais individuais. Outras alterações nos animais tratados com dulaglutida incluíram aumento do epitélio ductal interlobular sem proliferação celular ductal ativa (≥0,5 mg/kg), aumento da atrofia acinar com/sem inflamação (≥1,5 mg/kg) e aumento da inflamação neutrofílica de t o pâncreas acinar (5 mg/kg).
O tratamento de macacos durante 12 meses com 8,15 mg/kg/duas vezes por semana de dulaglutido (quase 200 vezes a MRHD com base na AUC) não demonstrou evidência de inflamação pancreática ou neoplasia intraepitelial pancreática. Em 4 dos 19 macacos tratados com dulaglutido, houve um aumento nas células caliciformes nos ductos pancreáticos, mas não houve diferenças em relação ao grupo de controle na amilase ou lipase total no final do estudo. Não houve alterações proliferativas nas células C da tireoide.
14. Estudos Clínicos
14.1 Visão Geral dos Ensaios Clínicos
TRULICITY foi estudado em adultos como monoterapia e em combinação com metformina, sulfonilureia, metformina e sulfonilureia, metformina e tiazolidinediona, inibidores do cotransportador de sódio-glicose-2 (SGLT2i) com ou sem metformina, insulina basal com ou sem metformina e prandial insulina com ou sem metformina. TRULICITY também foi estudado em pacientes com diabetes mellitus tipo 2 e insuficiência renal moderada a grave.
O escalonamento da dose foi realizado em um ensaio em adultos com doses de TRULICITY de até 4,5 mg adicionadas à metformina. Todos os outros estudos clínicos em adultos avaliaram TRULICITY 0,75 mg e 1,5 mg sem aumento de dose; os pacientes foram iniciados e mantidos com 0,75 mg ou 1,5 mg durante os ensaios.
TRULICITY 0,75 mg e 1,5 mg foi estudado em pacientes pediátricos com 10 anos de idade ou mais com diabetes tipo 2 em combinação com ou sem metformina e/ou tratamento com insulina basal.
Em pacientes com diabetes mellitus tipo 2, TRULICITY produziu reduções desde o início do estudo na HbA1c em comparação com o placebo. Não foram observadas diferenças globais na eficácia glicémica entre subgrupos demográficos (idade, sexo, raça/etnia, duração da diabetes).
Um ensaio de resultados cardiovasculares foi realizado em pacientes adultos com diabetes mellitus tipo 2 e doença cardiovascular (CV) estabelecida ou múltiplos fatores de risco cardiovascular. Os pacientes foram randomizados para TRULICITY 1,5 mg ou placebo, ambos adicionados ao tratamento padrão. TRULICITY reduziu significativamente o risco de primeira ocorrência de desfecho primário composto de morte cardiovascular, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal.
14.2 Ensaios de monoterapia de controle glicêmico em adultos com diabetes mellitus tipo 2
Em um estudo duplo-cego com desfecho primário em 26 semanas, 807 pacientes adultos tratados inadequadamente com dieta e exercícios, ou com dieta e exercícios e um agente antidiabético usado em dose submáxima, foram randomizados para TRULICITY 0,75 mg uma vez por semana, TRULICITY 1,5 mg uma vez semanalmente ou metformina 1.500 a 2.000 mg/dia após um intervalo de duas semanas. Setenta e cinco por cento (75%) da população randomizada foram tratados com um agente antidiabético na visita de triagem. A maioria dos pacientes previamente tratados com um agente antidiabético estava recebendo metformina (~90%) em uma dose média de 1.000 mg por dia e aproximadamente 10% estava recebendo sulfonilureia.
Os pacientes tinham idade média de 56 anos e duração média de diabetes tipo 2 de 3 anos. Quarenta e quatro por cento eram do sexo masculino. As raças branca, negra e asiática representavam 74%, 7% e 8% da população, respectivamente. Vinte e nove por cento da população experimental era dos EUA.
O tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana resultou na redução da HbA1c desde o início do estudo às 26 semanas (Tabela 4). A diferença no tamanho do efeito observado entre TRULICITY 0,75 mg e 1,5 mg, respectivamente, e metformina excluiu a margem de não inferioridade pré-especificada de 0,4%.
| Abreviatura: HbA1c = hemoglobina A1c. | |||
| a População com intenção de tratar. A última observação realizada (LOCF) foi usada para imputar dados faltantes. Os dados pós-início da terapia de resgate são tratados como ausentes. Na semana 26, faltava eficácia primária para 10%, 12% e 14% dos indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e metformina, respectivamente. | |||
| b Média dos mínimos quadrados ajustada para valor basal e outros fatores de estratificação. | |||
| ‡ Os pacientes incluídos na análise são um subconjunto da população ITT que teve pelo menos uma avaliação pós-baseline. A análise primária incluiu 265 indivíduos em cada um dos braços de tratamento. | |||
| Ponto de tempo primário de 26 semanas | |||
| TRULICIDADE 0,75 mg | TRULICIDADE 1,5 mg | Metformina 1500-2000mg |
|
| População com intenção de tratar (ITT) (N)‡ | 270 | 269 | 268 |
| HbA1c (%) (média) | |||
| Linha de base | 7.6 | 7.6 | 7.6 |
| Mudança da linha de baseb | -0,7 | -0,8 | -0,6 |
| Glicose sérica em jejum (mg/dL) (média) | |||
| Linha de base | 161 | 164 | 161 |
| Mudança da linha de baseb | -26 | -29 | -24 |
| Peso corporal (kg) (média) | |||
| Linha de base | 91,8 | 92,7 | 92,4 |
| Mudança da linha de baseb | -1,4 | -2,3 | -2.2 |
14.3 Ensaios de terapia combinada de controle glicêmico em adultos com diabetes mellitus tipo 2
Ensaio controlado por sitagliptina (complemento à metformina)
Neste estudo duplo-cego, controlado por placebo, com desfecho primário em 52 semanas, 972 pacientes adultos foram randomizados para receber placebo, TRULICITY 0,75 mg uma vez por semana, TRULICITY 1,5 mg uma vez por semana ou sitagliptina 100 mg/dia (após 26 semanas, pacientes em o grupo de tratamento com placebo recebeu 100 mg/dia de sitagliptina em ocultação durante o restante do ensaio), tudo como complemento à metformina. A randomização ocorreu após um período de introdução de 11 semanas para permitir um período de titulação da metformina, seguido por um período de estabilização glicêmica de 6 semanas. Os pacientes tinham idade média de 54 anos; duração média do diabetes tipo 2 de 7 anos; 48% eram do sexo masculino; raça: Brancos, Negros e Asiáticos foram 53%, 4% e 27%, respectivamente; e 24% da população experimental estava nos EUA.
No período de 26 semanas controlado por placebo, a alteração da HbA1c foi de 0,1%, -1,0%, -1,2% e -0,6% para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg e sitagliptina, respectivamente. A porcentagem de pacientes que atingiram HbA1c <7,0% foi de 22%, 56%, 62% e 39% para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg e sitagliptina, respectivamente. Às 26 semanas, houve uma redução média de peso de 1,4 kg, 2,7 kg, 3,0 kg e 1,4 kg para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg e sitagliptina, respectivamente. Houve uma redução média da glicemia de jejum de 9 mg/dL, 35 mg/dL, 41 mg/dL e 18 mg/dL para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg e sitagliptina, respectivamente.
O tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana resultou numa redução estatisticamente significativa na HbA1c em comparação com o placebo (às 26 semanas) e em comparação com a sitagliptina (às 26 e 52 semanas), todos em combinação com metformina (Tabela 5 e Figura 3) .
| Abreviaturas: HbA1c = hemoglobina A1c. | |||
| a Todos os pacientes ITT randomizados após a parte do estudo para determinação da dose. A última observação realizada (LOCF) foi usada para imputar dados faltantes. Na semana 52, a eficácia primária estava ausente em 15%, 19% e 20% dos indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e sitagliptina, respectivamente. | |||
| b Média dos mínimos quadrados (MQ) ajustada pelo valor basal e outros fatores de estratificação. | |||
| ‡ Os pacientes incluídos na análise são um subconjunto da população ITT que teve pelo menos uma avaliação pós-baseline. A análise primária incluiu 276, 277 e 270 indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e sitagliptina, respectivamente. | |||
| †† Valor p unilateral ajustado pela multiplicidade <0,001, para superioridade de TRULICITY em comparação com sitagliptina, avaliada apenas para HbA1c. | |||
| ## p<0,001 TRULICIDADE em comparação à sitagliptina, avaliada apenas para HbA1c <7,0%. | |||
| Ponto de tempo primário de 52 semanas | |||
| TRULICIDADE 0,75mg |
TRULICIDADE 1,5mg |
Sitagliptina 100mg |
|
| População com intenção de tratar (ITT) (N)‡ | 281 | 279 | 273 |
| HbA1c (%) (média) | |||
| Linha de base | 8.2 | 8.1 | 8,0 |
| Mudança da linha de baseb | -0,9 | -1.1 | -0,4 |
| Diferença da sitagliptinab (IC 95%) | -0,5 (-0,7, -0,3)†† | -0,7 (-0,9, -0,5)†† | – |
| Porcentagem de pacientes com HbA1c <7,0% | 49## | 59## | 33 |
| Glicose plasmática em jejum (mg/dL) (média) | |||
| Linha de base | 174 | 173 | 171 |
| Mudança da linha de baseb | -30 | -41 | -14 |
| Diferença da sitagliptinab (IC 95%) | -15 (-22, -9) | -27 (-33, -20) | – |
| Peso corporal (kg) (média) | |||
| Linha de base | 85,5 | 86,5 | 85,8 |
| Mudança da linha de baseb | -2,7 | -3.1 | -1,5 |
| Diferença da sitagliptinab (IC 95%) | -1,2 (-1,8, -0,6) | -1,5 (-2,1, -0,9) | – |
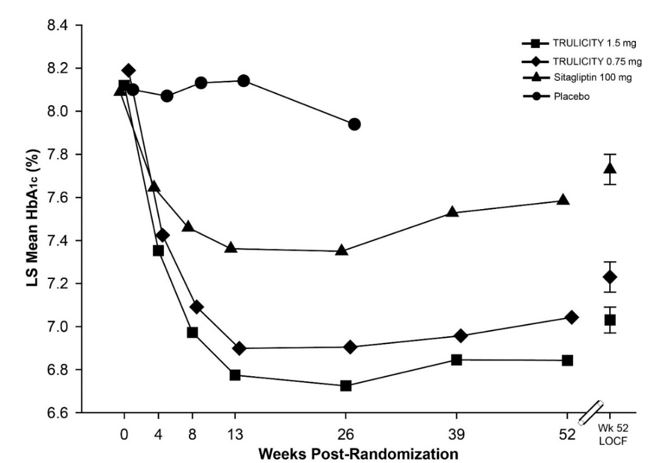
| HbA1c média ajustada para HbA1c basal e país. | |||
| Número de pacientes com dados observados | |||
| Placebo | 139 | 108 | |
| TRULICIDADE 0,75 mg | 281 | 258 | 238 |
| TRULICIDADE 1,5 mg | 279 | 249 | 225 |
| Sitagliptina | 273 | 241 | 219 |
Figura 3: HbA1c média ajustada em cada momento (ITT, MMRM) e na semana 52 (ITT, LOCF) em pacientes adultos com diabetes mellitus tipo 2
Ensaio de variação de dosagem de TRULICITY 1,5, 3 mg e 4,5 mg (complemento à metformina)
Neste estudo duplo-cego de braço paralelo com desfecho primário em 36 semanas, um total de 1.842 pacientes adultos foram randomizados 1:1:1 para TRULICITY 1,5 mg, TRULICITY 3 mg ou TRULICITY 4,5 mg uma vez por semana, todos como complemento. para metformina (NCT03495102).
Após a randomização, todos os pacientes receberam TRULICITY 0,75 mg uma vez por semana. A dose foi aumentada a cada 4 semanas para a próxima dose mais alta até que os pacientes atingissem a dose designada (1,5 mg, 3 mg ou 4,5 mg). Os pacientes deveriam permanecer com a dose atribuída ao estudo durante o ensaio.
Os pacientes tinham idade média de 57,1 anos; uma duração média de diabetes tipo 2 de 7,6 anos; 51,2% eram do sexo masculino; raça: brancos, negros e asiáticos foram 85,8%, 4,5% e 2,4%, respectivamente; e 27,6% da população experimental estava nos EUA.
Às 36 semanas, o tratamento com TRULICITY 4,5 mg resultou em uma redução estatisticamente significativa na HbA1c e no peso corporal em comparação com TRULICITY 1,5 mg (Tabela 6 e Figura 4).
| Abreviações: HbA1c = hemoglobina A1c | |||
| a População com intenção de tratar. Na semana 36, faltava eficácia primária para 7%, 7% e 6% dos indivíduos tratados com TRULICITY 1,5 mg, TRULICITY 3 mg e TRULICITY 4,5 mg, respectivamente. | |||
| b Média dos mínimos quadrados ajustada para valor basal e outros fatores de estratificação. Os dados faltantes foram imputados usando imputação múltipla. | |||
| c Os pacientes com dados faltantes de HbA1c na semana 36 foram considerados como não atingindo a meta de HbA1c. | |||
| ^ p = 0,0001 para superioridade em comparação com TRULICITY 1,5 mg, erro geral tipo I controlado. | |||
| ^^ p<0,0001 para superioridade em comparação com TRULICITY 1,5 mg, erro geral tipo I controlado. | |||
| Ponto de tempo primário de 36 semanas | |||
| TRULICIDADE 1,5mg |
TRULICIDADE 3mg |
TRULICIDADE 4,5mg |
|
| População com intenção de tratar (ITT) (N) | 612 | 616 | 614 |
| HbA1c (%) (média) | |||
| Linha de base | 8.6 | 8.6 | 8.6 |
| Mudança da linha de baseb | -1,5 | -1,6 | -1,8 |
| Diferença de 1,5 mgb (IC 95%) | -0,1 (-0,2, 0,0) | -0,2 (-0,4, -0,1) ^ | |
| Porcentagem de pacientes com HbA1c <7,0%c | 50 | 56 | 62 |
| Glicose sérica em jejum (mg/dL) (média) | |||
| Linha de base | 185 | 184 | 183 |
| Mudança da linha de baseb | -45 | -46 | -51 |
| Diferença de 1,5 mgb (IC 95%) | – 2 (-7, 3) | -6 (-11, -2) | |
| Peso corporal (kg) (média) | |||
| Linha de base | 95,5 | 96,3 | 95,4 |
| Mudança da linha de baseb | -3,0 | -3,8 | -4,6 |
| Diferença de 1,5 mgb (IC 95%) | -0,9 (-1,4, -0,4) | -1,6 (-2,2, -1,1) ^^ | |
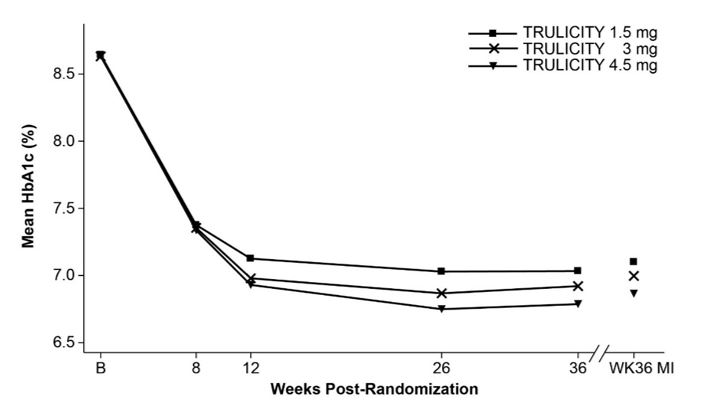
| HbA1c média observada em visitas agendadas e estimativa baseada em imputação múltipla (MI) de abandono recuperada na semana 36. | |||
| Número de pacientes com dados observados | |||
| TRULICIDADE 1,5 mg | 612 | 567 | |
| TRULICIDADE 3 mg | 616 | 572 | |
| TRULICIDADE 4,5 mg | 614 | 575 | |
Figura 4: HbA1c média em cada momento (ITT) e na semana 36 (ITT, MI)
Ensaio controlado por placebo (complemento da sulfonilureia)
Neste estudo duplo-cego, controlado por placebo, de 24 semanas, 299 pacientes adultos foram randomizados e receberam placebo ou TRULICITY 1,5 mg uma vez por semana, ambos como complemento à glimepirida. Os pacientes tinham idade média de 58 anos; duração média do diabetes tipo 2 de 8 anos; 44% eram do sexo masculino; raça: brancos, negros e asiáticos eram 83%, 4% e 2%, respectivamente; e 24% da população experimental estava nos EUA.
Às 24 semanas, o tratamento com TRULICITY 1,5 mg uma vez por semana resultou em uma redução estatisticamente significativa na HbA1c em comparação com o placebo (Tabela 7).
| Abreviaturas: HbA1c = hemoglobina A1c. | ||
| a População com intenção de tratar. Os dados pós-início da terapia de resgate são tratados como ausentes. Na semana 24, faltava eficácia primária para 10% e 12% dos indivíduos randomizados para TRULICITY 1,5 mg e placebo, respectivamente. | ||
| b Média dos mínimos quadrados da ANCOVA ajustada para valor basal e outros fatores de estratificação. A imputação múltipla do placebo, em relação aos valores basais, foi utilizada para modelar uma eliminação do efeito do tratamento para pacientes com dados faltantes da Semana 24. | ||
| c Os pacientes com dados faltantes de HbA1c na semana 24 foram considerados não respondedores. | ||
| †† p<0,001 para superioridade de TRULICITY 1,5 mg em comparação com placebo, erro geral tipo I controlado. | ||
| Ponto de tempo primário de 24 semanas | ||
| Placebo | TRULICIDADE 1,5mg |
|
| População com intenção de tratar (ITT) (N) | 60 | 239 |
| HbA1c (%) (média) | ||
| Linha de base | 8.4 | 8.4 |
| Mudança da linha de baseb | -0,3 | -1,3 |
| Diferença do placebob (IC 95%) | -1,1 (-1,4, -0,7)†† | |
| Porcentagem de pacientes com HbA1c <7,0%c | 17 | 50†† |
| Glicose sérica em jejum (mg/dL) (média) | ||
| Linha de base | 175 | 178 |
| Mudança da linha de baseb | 2 | -28 |
| Diferença do placebob (IC 95%) | -30 (-44, -15)†† | |
| Peso corporal (kg) (média) | ||
| Linha de base | 89,5 | 84,5 |
| Mudança da linha de baseb | -0,2 | -0,5 |
| Diferença do placebob (IC 95%) | -0,4 (-1,2, 0,5) | |
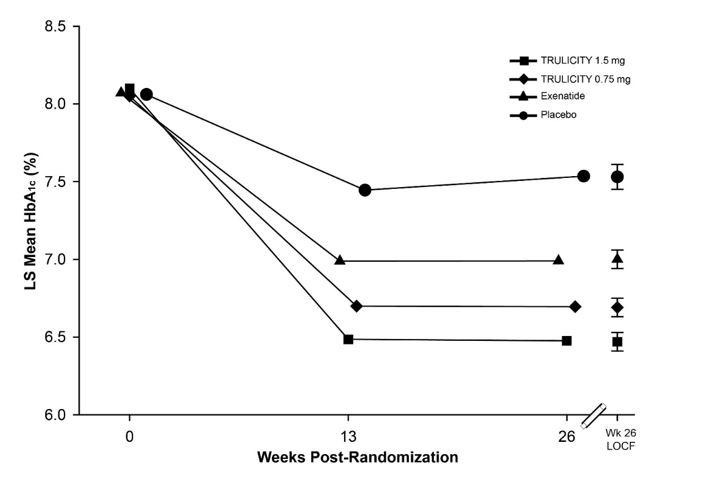
Ensaio controlado por placebo e exenatida (complemento à metformina e tiazolidinediona)
Neste estudo controlado por placebo com desfecho primário em 26 semanas, 976 pacientes adultos foram randomizados e receberam placebo, TRULICITY 0,75 mg uma vez por semana, TRULICITY 1,5 mg uma vez por semana ou exenatida 10 mcg BID, todos como complemento às doses máximas toleradas de metformina (≥1500 mg por dia) e pioglitazona (até 45 mg por dia). A atribuição do grupo de tratamento com exenatida foi aberta, enquanto as atribuições de tratamento para placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg foram cegadas. Após 26 semanas, os pacientes no grupo de tratamento com placebo foram randomizados para TRULICITY 0,75 mg uma vez por semana ou TRULICITY 1,5 mg uma vez por semana para manter o cegamento. A randomização ocorreu após um período de introdução de 12 semanas; durante as primeiras 4 semanas do período de introdução, os pacientes foram titulados para doses máximas toleradas de metformina e pioglitazona; isso foi seguido por um período de estabilização glicêmica de 8 semanas antes da randomização. Os pacientes randomizados para exenatida começaram com uma dose de 5 mcg BID por 4 semanas e depois foram aumentados para 10 mcg BID. Os pacientes tinham idade média de 56 anos; duração média do diabetes tipo 2 de 9 anos; 58% eram do sexo masculino; raça: Brancos, Negros e Asiáticos foram 74%, 8% e 3%, respectivamente; e 81% da população experimental estava nos EUA.
O tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana resultou em uma redução estatisticamente significativa na HbA1c em comparação com o placebo (em 26 semanas) e em comparação com exenatida em 26 semanas (Tabela 8 e Figura 5). Durante o período experimental de 52 semanas, a porcentagem de pacientes que necessitaram de resgate glicêmico foi de 8,9% no grupo de tratamento TRULICITY 0,75 mg uma vez por semana + metformina e pioglitazona, 3,2% no grupo de tratamento TRULICITY 1,5 mg uma vez por semana + metformina e pioglitazona, e 8,7% no grupo de tratamento com exenatida BID + metformina e pioglitazona.
| Abreviaturas: BID = duas vezes ao dia; HbA1c = hemoglobina A1c. | ||||
| a População com intenção de tratar. A última observação realizada (LOCF) foi usada para imputar dados faltantes. Os dados pós-início da terapia de resgate são tratados como ausentes. Na semana 26, faltava eficácia primária para 23%, 10%, 7% e 12% dos indivíduos randomizados para receber placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg e exenatida, respectivamente. | ||||
| b Média dos mínimos quadrados (MQ) ajustada pelo valor basal e outros fatores de estratificação. | ||||
| ‡ Os pacientes incluídos na análise são um subconjunto da população ITT que teve pelo menos uma avaliação pós-baseline. A análise primária incluiu 119, 269, 271 e 266 indivíduos randomizados para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg e exenatida, respectivamente. | ||||
| ‡‡ Valor p unilateral ajustado pela multiplicidade <0,001, para superioridade de TRULICITY em comparação ao placebo, avaliado apenas para HbA1c. | ||||
| †† Valor p unilateral ajustado pela multiplicidade <0,001, para superioridade de TRULICITY em comparação com exenatida, avaliada apenas para HbA1c. | ||||
| ** p<0,001 TRULICITY comparado ao placebo, avaliado apenas para HbA1c <7,0%. | ||||
| ## p<0,001 TRULICIDADE em comparação com exenatida, avaliada apenas para HbA1c <7,0%. | ||||
| Ponto de tempo primário de 26 semanas | ||||
| Placebo | TRULICIDADE 0,75mg |
TRULICIDADE 1,5mg |
Exenatida 10 mcg BID |
|
| População com intenção de tratar (ITT) (N)‡ | 141 | 280 | 279 | 276 |
| HbA1c (%) (média) | ||||
| Linha de base | 8.1 | 8.1 | 8.1 | 8.1 |
| Mudança da linha de baseb | -0,5 | -1,3 | -1,5 | -1,0 |
| Diferença do placebob (IC 95%) | – | -0,8 (-1,0, -0,7)‡‡ | -1,1 (-1,2, -0,9)‡‡ | – |
| Diferença de exenatidab (IC 95%) | – | -0,3 (-0,4, -0,2)†† | -0,5 (-0,7, -0,4)†† | – |
| Porcentagem de pacientes com HbA1c <7,0% | 43 | 66**## | 78**## | 52 |
| Glicose sérica em jejum (mg/dL) (média) | ||||
| Linha de base | 166 | 159 | 162 | 164 |
| Mudança da linha de baseb | -5 | -34 | -42 | -24 |
| Diferença do placebob (IC 95%) | – | -30 (-36, -23) | -38 (-45, -31) | – |
| Diferença de exenatidab (IC 95%) | – | -10 (-15, -5) | -18 (-24, -13) | – |
| Peso corporal (kg) (média) | ||||
| Linha de base | 94,1 | 95,5 | 96,2 | 97,4 |
| Mudança da linha de baseb | 1.2 | 0,2 | -1,3 | -1.1 |
| Diferença do placebob (IC 95%) | – | -1,0 (-1,8, -0,3) | -2,5 (-3,3, -1,8) | – |
| Diferença de exenatidab (IC 95%) | – | 1,3 (0,6, 1,9) | -0,2 (-0,9, 0,4) | – |
| HbA1c média ajustada para HbA1c basal e país. | |||
| Número de pacientes com dados observados | |||
| Placebo | 141 | 108 | |
| TRULICIDADE 0,75 mg | 280 | 251 | |
| TRULICIDADE 1,5 mg | 279 | 259 | |
| Exenatida | 276 | 242 | |
Figura 5: HbA1c média ajustada em cada momento (ITT, MMRM) e na semana 26 (ITT, LOCF)
Ensaio controlado por placebo (complemento ao SGLT2i, com ou sem metformina)
Neste estudo duplo-cego, controlado por placebo, de 24 semanas, 423 pacientes adultos foram randomizados e receberam TRULICITY 0,75 mg, TRULICITY 1,5 mg ou placebo, como complemento à terapia com inibidor do cotransportador de sódio-glicose 2 (SGLT2i). (96% com e 4% sem metformina). O Trulicity foi administrado uma vez por semana e o SGLT2i foi administrado de acordo com o rótulo local do país. Os pacientes tinham idade média de 57 anos; duração média do diabetes tipo 2 de 9,4 anos; 50% eram do sexo masculino; raça: brancos, negros e asiáticos foram 89%, 3% e 0,2%, respectivamente; e 21% da população experimental estava nos EUA.
Às 24 semanas, o tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana resultou em uma redução estatisticamente significativa da linha de base na HbA1c em comparação com o placebo (Tabela 9).
O peso corporal médio basal foi de 90,5, 91,1 e 92,9 kg nos grupos placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente. As alterações médias desde o início do peso corporal na semana 24 foram -2,0, -2,5 e -2,9 kg para placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente. A diferença em relação ao placebo (IC 95%) foi de -0,9 kg (-1,7, -0,1) para TRULICITY 1,5 mg.
| Abreviaturas: HbA1c = hemoglobina A1c; SGLT2i = inibidores do cotransportador 2 de sódio-glicose. | |||
| a População com intenção de tratar. Na semana 24, faltava eficácia primária para 3%, 4% e 6% dos indivíduos tratados com placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente. | |||
| b Média dos mínimos quadrados ajustada para valor basal e outros fatores de estratificação. A imputação múltipla de placebo, usando valores basais e de 24 semanas do braço placebo, foi aplicada para modelar uma eliminação do efeito do tratamento para pacientes que perderam valores de 24 semanas (HbA1c, glicemia sérica em jejum e peso corporal). | |||
| c Os pacientes com dados faltantes de HbA1c na semana 24 foram considerados não respondedores. | |||
| †† p<0,001 para superioridade de TRULICITY em comparação com placebo, erro geral tipo I controlado. | |||
| Ponto de tempo primário de 24 semanas | |||
| Placebo | TRULICIDADE 0,75mg |
TRULICIDADE 1,5mg |
|
| População com intenção de tratar (ITT) (N) | 140 | 141 | 142 |
| HbA1c (%) (média) | |||
| Linha de base | 8.1 | 8.1 | 8,0 |
| Mudança da linha de baseb | -0,6 | -1,2 | -1,3 |
| Diferença do placebob (IC 95%) | – | -0,7 (-0,8, -0,5)†† | -0,8 (-0,9, -0,6)†† |
| Porcentagem de pacientes com HbA1c <7,0%c | 31 | 59†† | 67†† |
| Glicose sérica em jejum (mg/dL) (média) | |||
| Linha de base | 153 | 162 | 161 |
| Mudança da linha de baseb | -6 | -25 | -30 |
| Diferença do placebob (IC 95%) | – | -19 (-25, -13) | -24 (-30, -18)†† |
Ensaio controlado com insulina glargina (complemento à metformina e sulfonilureia)
Neste estudo comparador aberto (duplo-cego em relação à atribuição de dose de TRULICITY) com desfecho primário em 52 semanas, 807 pacientes adultos foram randomizados e receberam TRULICITY 0,75 mg uma vez por semana, TRULICITY 1,5 mg uma vez por semana ou insulina glargina uma vez ao dia , tudo como complemento às doses máximas toleradas de metformina e glimepirida. A randomização ocorreu após um período de introdução de 10 semanas; durante as 2 semanas iniciais do período de introdução, os pacientes foram titulados para doses máximas toleradas de metformina e glimepirida. Isto foi seguido por um período de estabilização glicêmica de 6 a 8 semanas antes da randomização.
Os pacientes randomizados para receber insulina glargina iniciaram uma dose de 10 unidades uma vez ao dia. Os ajustes de dose de insulina glargina ocorreram duas vezes por semana durante as primeiras 4 semanas de tratamento com base na glicemia de jejum (FPG) auto-medida, seguida de titulação uma vez por semana até a semana 8 de tratamento, utilizando um algoritmo que visava uma glicemia de jejum de <100 mg /dL. Apenas 24% dos pacientes foram titulados até a meta no endpoint primário de 52 semanas. A dose de glimepirida poderia ser reduzida ou descontinuada após a randomização (a critério do investigador) em caso de hipoglicemia persistente. A dose de glimepirida foi reduzida ou descontinuada em 28%, 32% e 29% dos pacientes randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e glargina.
Os pacientes tinham idade média de 57 anos; duração média do diabetes tipo 2 de 9 anos; 51% eram do sexo masculino; raça: Brancos, Negros e Asiáticos foram 71%, 1% e 17%, respectivamente; e 0% da população experimental estava nos EUA.
O tratamento com TRULICITY uma vez por semana resultou em uma redução na HbA1c em relação ao valor basal às 52 semanas quando usado em combinação com metformina e sulfonilureia (Tabela 10). A diferença no tamanho do efeito observado entre TRULICITY 0,75 mg e 1,5 mg, respectivamente, e glargina neste estudo excluiu a margem de não inferioridade pré-especificada de 0,4%.
| Abreviaturas: HbA1c = hemoglobina A1c. | |||
| a População com intenção de tratar. A última observação realizada (LOCF) foi usada para imputar dados faltantes. Os dados pós-início da terapia de resgate são tratados como ausentes. Na semana 52, faltava eficácia primária para 17%, 13% e 12% dos indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e glargina, respectivamente. | |||
| b Média dos mínimos quadrados (MQ) ajustada pelo valor basal e outros fatores de estratificação. | |||
| ‡ Os pacientes incluídos na análise são um subconjunto da população ITT que teve pelo menos uma avaliação pós-baseline. A análise primária incluiu 267, 263 e 259 indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e glargina, respectivamente. | |||
| Ponto de tempo primário de 52 semanas | |||
| TRULICIDADE 0,75mg |
TRULICIDADE 1,5mg |
Insulina Glargina | |
| População com intenção de tratar (ITT) (N)‡ | 272 | 273 | 262 |
| HbA1c (%) (média) | |||
| Linha de base | 8.1 | 8.2 | 8.1 |
| Mudança da linha de baseb | -0,8 | -1.1 | -0,6 |
| Glicose sérica em jejum (mg/dL) (média) | |||
| Linha de base | 161 | 165 | 163 |
| Mudança da linha de baseb | -16 | -27 | -32 |
| Diferença da insulina glarginab (IC 95%) | 16 (9, 23) | 5 (-2, 12) | – |
| Peso corporal (kg) (média) | |||
| Linha de base | 86,4 | 85,2 | 87,6 |
| Mudança da linha de baseb | -1,3 | -1,9 | 1.4 |
| Diferença da insulinab (IC 95%) | -2,8 (-3,4, -2,2) | -3,3 (-3,9, -2,7) | – |
Ensaio controlado por placebo (complemento à insulina basal, com ou sem metformina)
Neste estudo duplo-cego, controlado por placebo, de 28 semanas, 300 pacientes adultos foram randomizados para receber placebo ou TRULICITY 1,5 mg uma vez por semana, como complemento à insulina glargina basal titulada (com ou sem metformina). Os pacientes tinham idade média de 60 anos; duração média do diabetes tipo 2 de 13 anos; 58% eram do sexo masculino; raça: brancos, negros e asiáticos foram 94%, 4% e 0,3%, respectivamente; e 20% da população experimental estava nos EUA.
A dose inicial média de insulina glargina foi de 37 unidades/dia para pacientes que receberam placebo e 41 unidades/dia para pacientes que receberam TRULICITY 1,5 mg. Na randomização, a dose inicial de insulina glargina em pacientes com HbA1c <8,0% foi reduzida em 20%.
Às 28 semanas, o tratamento com TRULICITY 1,5 mg uma vez por semana resultou em uma redução estatisticamente significativa na HbA1c em comparação com o placebo (Tabela 11).
| Abreviaturas: HbA1c = hemoglobina A1c. | ||
| a População com intenção de tratar. Na semana 28, faltava eficácia primária para 12% e 8% dos indivíduos randomizados para receber placebo e TRULICITY 1,5 mg, respectivamente. | ||
| b Média dos mínimos quadrados da ANCOVA ajustada para valor basal e outros fatores de estratificação. A imputação múltipla do placebo, em relação aos valores basais, foi utilizada para modelar uma eliminação do efeito do tratamento para pacientes com dados faltantes da Semana 28. | ||
| c Os pacientes com dados faltantes de HbA1c na semana 28 foram considerados não respondedores. | ||
| †† p<0,001 para superioridade de TRULICITY 1,5 mg em comparação com placebo, erro geral tipo I controlado. | ||
| † p≤0,005 para superioridade de TRULICITY 1,5 mg em comparação com placebo, erro geral tipo I controlado. | ||
| Ponto de tempo primário de 28 semanas | ||
| Placebo | TRULICIDADE 1,5mg |
|
| População com intenção de tratar (ITT) (N) | 150 | 150 |
| HbA1c (%) (média) | ||
| Linha de base | 8.3 | 8.4 |
| Mudança da linha de baseb | -0,7 | -1,4 |
| Diferença do placebob (IC 95%) | -0,7 (-0,9, -0,5)†† | |
| Porcentagem de pacientes com HbA1c <7,0%c | 33 | 67†† |
| Glicose sérica em jejum (mg/dL) (média) | ||
| Linha de base | 156 | 157 |
| Mudança da linha de baseb | -30 | -44 |
| Diferença do placebob (IC 95%) | -14 (-23, -4)† | |
| Peso corporal (kg) (média) | ||
| Linha de base | 92,6 | 93,3 |
| Mudança da linha de baseb | 0,8 | -1,3 |
| Diferença do placebob (IC 95%) | -2,1 (-2,9, -1,4)†† | |
Ensaio controlado com insulina glargina (combinação com insulina prandial, com ou sem metformina)
Neste estudo comparador aberto (duplo-cego em relação à atribuição de dose de TRULICITY) com desfecho primário em 26 semanas, foram incluídos 884 pacientes adultos recebendo 1 ou 2 injeções de insulina por dia. A randomização ocorreu após um período de introdução de 9 semanas; durante as 2 semanas iniciais do período de introdução, os pacientes continuaram seu regime de insulina pré-ensaio, mas puderam ser iniciados e/ou aumentados com metformina, com base no critério do investigador; isso foi seguido por um período de estabilização glicêmica de 7 semanas antes da randomização.
Na randomização, os pacientes descontinuaram seu regime de insulina pré-ensaio e foram randomizados para TRULICITY 0,75 mg uma vez por semana, TRULICITY 1,5 mg uma vez por semana ou insulina glargina uma vez ao dia, todos em combinação com insulina lispro prandial 3 vezes ao dia, com ou sem metformina. A insulina lispro foi titulada em cada braço com base na glicemia pré-prandial e antes de dormir, e a insulina glargina foi titulada para uma meta de glicemia em jejum de <100 mg/dL. Apenas 36% dos pacientes randomizados para glargina foram titulados para a meta de glicemia de jejum no período primário de 26 semanas.
Os pacientes tinham idade média de 59 anos; duração média do diabetes tipo 2 de 13 anos; 54% eram do sexo masculino; raça: Brancos, Negros e Asiáticos foram 79%, 10% e 4%, respectivamente; e 33% da população experimental estava nos EUA.
O tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana resultou em uma redução na HbA1c em relação ao valor basal. A diferença no tamanho do efeito observado entre TRULICITY 0,75 mg e 1,5 mg, respectivamente, e glargina neste estudo excluiu a margem de não inferioridade pré-especificada de 0,4% (Tabela 12).
| Abreviatura: HbA1c = hemoglobina A1c | |||
| a População com intenção de tratar. A última observação realizada (LOCF) foi usada para imputar dados faltantes. Os dados pós-início da terapia de resgate são tratados como ausentes. Na semana 26, faltava eficácia primária para 14%, 15% e 14% dos indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e glargina, respectivamente. | |||
| b Média dos mínimos quadrados (MQ) ajustada pelo valor basal e outros fatores de estratificação. | |||
| ‡ Os pacientes incluídos na análise são um subconjunto da população ITT que teve pelo menos uma avaliação pós-baseline. A análise primária incluiu 275, 273 e 276 indivíduos randomizados para TRULICITY 0,75 mg, TRULICITY 1,5 mg e glargina, respectivamente. | |||
| Ponto de tempo primário de 26 semanas | |||
| TRULICIDADE 0,75mg |
TRULICIDADE 1,5mg |
Insulina Glargina | |
| População com intenção de tratar (ITT) (N)‡ | 293 | 295 | 296 |
| HbA1c (%) (média) | |||
| Linha de base | 8.4 | 8,5 | 8,5 |
| Mudança da linha de baseb | -1,6 | -1,6 | -1,4 |
| Glicose sérica em jejum (mg/dL) (média) | |||
| Linha de base | 150 | 157 | 154 |
| Mudança da linha de baseb | 4 | -5 | -28 |
| Diferença da insulina glarginab (IC 95%) | 32 (24, 41) | 24 (15, 32) | – |
| Peso corporal (kg) (média) | |||
| Linha de base | 91,7 | 91,0 | 90,8 |
| Mudança da linha de baseb | 0,2 | -0,9 | 2.3 |
| Diferença da insulina glarginab (IC 95%) | -2,2 (-2,8, -1,5) | -3,2 (-3,8, -2,6) | – |
14.4 Ensaios de controle glicêmico em adultos com diabetes mellitus tipo 2 e doença renal crônica moderada a grave
Neste estudo comparador aberto (duplo-cego em relação à atribuição de dose de TRULICITY) com desfecho primário em 26 semanas, um total de 576 pacientes adultos com diabetes tipo 2 foram randomizados e tratados para comparar TRULICITY 0,75 mg e 1,5 mg com insulina glargina (NCT01621178).
Patie pacientes em uso de insulina e outras terapias antidiabéticas (por exemplo, medicamentos antidiabéticos orais, pramlintide) tiveram terapias não insulínicas descontinuadas e tiveram sua dose de insulina ajustada por 12 semanas antes da randomização. Os pacientes em terapia isolada com insulina mantiveram uma dose de insulina estável durante 3 semanas antes da randomização. Na randomização, os pacientes descontinuaram seu regime de insulina pré-ensaio e os pacientes foram randomizados para TRULICITY 0,75 mg uma vez por semana, TRULICITY 1,5 mg uma vez por semana ou insulina glargina uma vez ao dia, todos em combinação com insulina lispro prandial. Para pacientes randomizados para receber insulina glargina, a dose inicial de insulina glargina foi baseada na dose basal de insulina antes da randomização. A insulina glargina foi titulada com uma meta de glicemia de jejum de ≤150 mg/dL. A insulina lispro foi autorizada a ser titulada com uma meta de glicose pré-prandial e ao deitar de ≤180 mg/dL.
Os pacientes tinham idade média de 65 anos; uma duração média de diabetes tipo 2 de 18 anos; 52% eram do sexo masculino; raça: brancos, negros e asiáticos eram 69%, 16% e 3%, respectivamente; e 32% da população experimental estava nos EUA. No início do estudo, a média geral da TFGe foi de 38 mL/min/1,73 m230% dos pacientes tinham TFGe <30 mL/min/1,73 m2, e 45% dos pacientes apresentavam macroalbuminúria. Pacientes que receberam mais de 70 unidades/dia de insulina basal foram excluídos do estudo.
O tratamento com TRULICITY 0,75 mg e 1,5 mg uma vez por semana resultou em uma redução na HbA1c 26 semanas desde o início do estudo. A diferença no tamanho do efeito observado entre TRULICITY 0,75 mg e 1,5 mg, respectivamente, e glargina neste estudo excluiu a margem de não inferioridade pré-especificada de 0,4%. A glicose plasmática média em jejum aumentou nos braços TRULICITY (Tabela 13).
O peso corporal médio basal foi de 90,9 kg, 88,1 kg e 88,2 kg nos braços TRULICITY 0,75 mg, TRULICITY 1,5 mg e insulina glargina, respectivamente. As alterações médias desde o início do estudo na semana 26 foram -1,1, -2 e 1,9 kg nos braços TRULICITY 0,75 mg, TRULICITY 1,5 mg e insulina glargina, respectivamente.
| Abreviatura: HbA1c = hemoglobina A1c | |||
| a A população com intenção de tratar (todos os pacientes randomizados e tratados) foi utilizada na análise, independentemente da descontinuação do medicamento do estudo ou do início da terapia de resgate. Na semana 26, faltava eficácia primária para 12%, 15% e 9% dos indivíduos randomizados e tratados com TRULICITY 0,75 mg, TRULICITY 1,5 mg e insulina glargina, respectivamente. Os dados faltantes foram imputados usando imputação múltipla dentro do grupo de tratamento. | |||
| b Média dos mínimos quadrados (LS) do modelo de mistura de padrões ANCOVA ajustado para o valor da linha de base e outros fatores de estratificação. | |||
| Ponto de tempo primário de 26 semanas | |||
| TRULICIDADE 0,75mg |
TRULICIDADE 1,5mg |
Insulina Glargina | |
| População com intenção de tratar (N) | 190 | 192 | 194 |
| HbA1c (%) (média) | |||
| Linha de base | 8.6 | 8.6 | 8.6 |
| Mudança da linha de baseb | -0,9 | -1,0 | -1,0 |
| Diferença da insulina glarginab (IC 95%) | 0,0 (-0,2, 0,3) | -0,1 (-0,3, 0,2) | |
| Porcentagem de pacientes HbA1c <8,0% | 73 | 75 | 74 |
| Glicose sérica em jejum (mg/dL) (média) | |||
| Linha de base | 167 | 161 | 170 |
| Mudança da linha de baseb | 6 | 14 | -23 |
| Diferença da insulina glarginab (IC 95%) | 30 (16, 43) | 37 (24, 50) | |
14.5 Ensaio de Resultados Cardiovasculares em Adultos com Diabetes Mellitus Tipo 2 e Doença Cardiovascular ou Múltiplos Fatores de Risco Cardiovascular
O ensaio REWIND (NCT01394952) foi um ensaio multinacional, multicêntrico, randomizado, controlado por placebo e duplo-cego. Neste estudo, 9.901 pacientes adultos com diabetes mellitus tipo 2 e doença cardiovascular (CV) estabelecida ou múltiplos fatores de risco cardiovascular foram randomizados para TRULICITY 1,5 mg ou placebo, ambos adicionados ao tratamento padrão. A duração média do acompanhamento foi de 5,4 anos. O endpoint primário foi o tempo até a primeira ocorrência de um resultado composto de Eventos Cardiovasculares Adversos Maiores (MACE) de 3 componentes, que incluiu morte CV, infarto do miocárdio (IM) não fatal e acidente vascular cerebral não fatal.
Os pacientes elegíveis para entrar no estudo tinham 50 anos de idade ou mais, tinham diabetes mellitus tipo 2, tinham um valor de HbA1c ≤9,5% sem limite inferior na triagem e tinham doença CV estabelecida ou não tinham doença CV estabelecida, mas tinham múltiplos fatores de risco CV. Os pacientes que tiveram doença CV estabelecida confirmada (31,5% dos pacientes randomizados) tinham histórico de pelo menos um dos seguintes: IM (16,2%); isquemia miocárdica por teste de esforço ou por imagem cardíaca (9,3%); acidente vascular cerebral isquêmico (5,3%); revascularização de artérias coronárias, carótidas ou periféricas (18,0%); angina instável (5,9%); ou hospitalização por angina instável com pelo menos um dos seguintes: alterações no ECG, isquemia miocárdica nos exames de imagem ou necessidade de intervenção coronária percutânea (12,0%). Os pacientes confirmados sem doença CV estabelecida, mas com múltiplos fatores de risco CV, representaram 62,8% da população do ensaio randomizado.
No início do estudo, as características demográficas e da doença foram equilibradas entre os grupos de tratamento. Os pacientes tinham idade média de 66 anos; 46% eram mulheres; raça: brancos, negros e asiáticos eram 76%, 7% e 4%, respectivamente.
A mediana da HbA1c basal foi de 7,2%. A duração média do diabetes tipo 2 foi de 10,5 anos e o IMC médio foi de 32,3 kg/m2.
No início do estudo, 50,5% dos pacientes apresentavam insuficiência renal leve (TFGe ≥60, mas <90 mL/min/1,73m2), 21,6% apresentavam insuficiência renal moderada (TFGe ≥30, mas <60 mL/min/1,73m2), e 1,1% dos pacientes apresentavam insuficiência renal grave (TFGe <30 mL/min/1,73m2) de 9.713 pacientes cuja TFGe estava disponível.
No início do estudo, 94,7% dos pacientes estavam tomando medicação antidiabética, com 10,5% dos pacientes tomando três ou mais medicamentos antidiabéticos. Os medicamentos antidiabéticos de base mais comuns utilizados no início do estudo foram metformina (81,2%), sulfonilureia (46,0%) e insulina (23,9%). No início do estudo, a doença cardiovascular e os fatores de risco foram tratados com inibidores da ECA ou bloqueadores dos receptores da angiotensina (81,5%), betabloqueadores (45,6%), bloqueadores dos canais de cálcio (34,4%), diuréticos (46,5%), terapia com estatinas (66,1%), agentes antitrombóticos (58,7%) e aspirina (51,7%). Durante o estudo, os investigadores deveriam modificar os medicamentos antidiabéticos e cardiovasculares para atingir as metas locais de tratamento padrão em relação à glicemia, lipídios e pressão arterial, e gerenciar pacientes em recuperação de uma síndrome coronariana aguda ou acidente vascular cerebral de acordo com as diretrizes de tratamento locais. .
Para a análise primária, um modelo de riscos proporcionais de Cox foi utilizado para testar a superioridade. O erro tipo I foi controlado em vários testes. TRULICITY reduziu significativamente o risco de primeira ocorrência de desfecho primário composto de morte cardiovascular, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal (HR: 0,88, IC 95% 0,79, 0,99). Consulte a Figura 6 e a Tabela 14.
O estado vital estava disponível para 99,7% dos pacientes no estudo. Um total de 1.128 mortes foram registradas durante o ensaio REWIND. A maioria das mortes no estudo foram julgadas como mortes CV, e as mortes não CV foram comparáveis entre os grupos de tratamento (4,4% em pacientes tratados com TRULICITY e 5,0% em pacientes tratados com placebo). Houve 536 mortes por todas as causas (10,8%) no grupo do dulaglutido em comparação com 592 mortes (12,0%) no grupo do placebo.
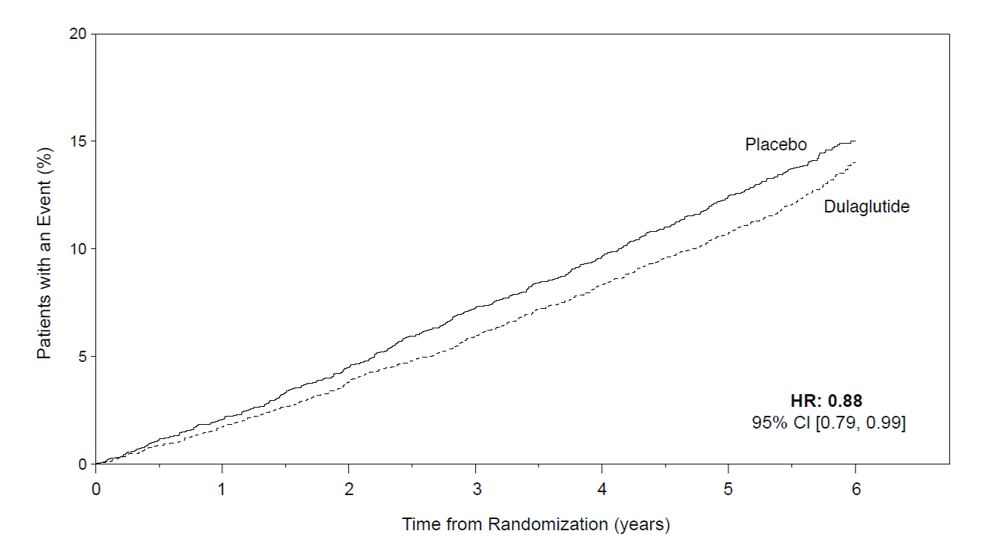
| Número de pacientes em risco | ||||||||
| Placebo | 4952 | 4791 | 4625 | 4437 | 4275 | 3575 | 742 | |
| Dulaglutida | 4949 | 4815 | 4670 | 4521 | 4369 | 3686 | 741 | |
Figura 6. CURVA KAPLAN MEIER: Tempo até a primeira ocorrência de MACE no ensaio REWIND
| a Todos os pacientes randomizados. | |||
| b Modelo de riscos proporcionais de Cox com tratamento como fator. O erro tipo I foi controlado para os endpoints primário e secundário. | |||
| c p=0,026 para superioridade (bilateral). | |||
| d Número e percentual de pacientes com eventos. | |||
| e Os resultados dos componentes de MACE, AVC fatal e não fatal e EM fatal e não fatal são listados descritivamente para fins de suporte. Nenhuma significância estatística deve ser inferida, uma vez que estes ICs não são ajustados pela multiplicidade. | |||
| Tempo para a primeira ocorrência de: | TRULICIDADE N=4949 |
Placebo N=4952 |
Taxa de risco (IC 95%)b |
| Composto de infarto do miocárdio não fatal, acidente vascular cerebral não fatal, morte cardiovascular (MACE)d | 594 (12,0%) | 663 (13,4%) | 0,88 (0,79, 0,99)c |
| Morte cardiovasculard,e | 317 (6,4%) | 346 (7,0%) | 0,91 (0,78, 1,06) |
| Infarto do miocárdio não fatald,e | 205 (4,1%) | 212 (4,3%) | 0,96 (0,79, 1,16) |
| AVC não fatald,e | 135 (2,7%) | 175 (3,5%) | 0,76 (0,61, 0,95) |
| Infarto do miocárdio fatal ou não fatald,e | 223 (4,5%) | 231 (4,7%) | 0,96 (0,79, 1,15) |
| AVC fatal ou não fatald,e | 158 (3,2%) | 205 (4,1%) | 0,76 (0,62, 0,94) |
14.6 Ensaio de controle glicêmico em pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2
Neste estudo multicêntrico, randomizado, duplo-cego, controlado por placebo, de braços paralelos, com duração de 26 semanas e extensão aberta por mais 26 semanas, 154 pacientes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2, que tiveram controle glicêmico inadequado apesar da dieta e exercício, foram randomizados para TRULICITY subcutâneo uma vez por semana (0,75 mg e 1,5 mg) ou placebo subcutâneo uma vez por semana em combinação com ou sem metformina e/ou tratamento com insulina basal (NCT02963766).
No geral, neste ensaio, as características demográficas e basais da doença foram comparáveis entre os grupos de tratamento. No início do estudo, 71% dos pacientes eram do sexo feminino e a idade média era de 14,5 anos (variando de 10 a 17 anos). No geral, 55% eram brancos, 15% eram negros ou afro-americanos, 12% eram asiáticos, 10% eram índios americanos ou nativos do Alasca, 5% eram de outras raças e 3% tinham raça desconhecida. Além disso, 55% eram hispânicos ou latinos, 42% não eram hispânicos ou latinos e 3% tinham etnia desconhecida. No início do estudo, a duração média do diabetes mellitus tipo 2 foi de 2 anos, a HbA1c média foi de 8,1%, o peso médio foi de 90,5 kg e o IMC médio foi de 34,1 kg/m2.
Neste ensaio, TRULICITY uma vez por semana (0,75 mg e 1,5 mg, agrupados) (com ou sem metformina e/ou insulina basal) foi superior ao placebo (p<0,001) na alteração da linha de base na semana 26 na HbA1c em pacientes pediátricos 10 anos de idade ou mais com diabetes mellitus tipo 2 (ver Tabela 15).
| Abreviaturas: HbA1c = hemoglobina A1c. | |||||
| a Resultados combinados para TRULICITY 0,75 mg e 1,5 mg. A comparação das duas dosagens em conjunto e individualmente com placebo foi pré-especificada com erro geral tipo I controlado. | |||||
| b A alteração em relação ao valor basal e a diferença em relação ao placebo foram analisadas usando análise de covariância com efeitos para o tratamento, o valor basal como covariável e fatores de estratificação que eram HbA1c na triagem (< 8% vs >= 8%), uso de insulina no início do estudo (sim/ não), uso de metformina no início do estudo (sim/não). | |||||
| c Para HbA1c e glicemia de jejum, foi realizada imputação múltipla para dados faltantes guiada pelo método de washout. Na semana 26, a eficácia primária (HbA1c) estava ausente em 8%, 6% e 10% dos pacientes que receberam placebo, TRULICITY 0,75 mg e TRULICITY 1,5 mg, respectivamente. | |||||
| d Para a porcentagem de pacientes com HbA1c < 7%, os dados faltantes foram imputados como não cumprimento da meta. | |||||
| Placebo | TRULICIDADE 0,75 mg uma vez por semana | TRULICIDADE 1,5 mg uma vez por semana | TRULICITY uma vez por semana Agrupadosa |
||
| População com intenção de tratar (N) | 51 | 51 | 52 | 103 | |
| HbA1c (%) (média)c | |||||
| Linha de base Alteração da linha de base na Semana 26b Diferença do placebo (IC 95%)b |
8.1 0,6 – |
7,9 -0,6 -1,2 (-1,8, -0,6) |
8.2 -0,9 -1,5 (-2,1, -0,9) |
8,0 -0,8 -1,4 (-1,9, -0,8) |
|
| Porcentagem de pacientes com HbA1c <7,0% na semana 26d | 14% | 55% | 48% | 52% | |
| Glicose no sangue em jejum (mg/dL) (média)c | |||||
| Linha de base Alteração da linha de base na semana 26b Diferença do placebo (IC 95%)b |
159 17.1 – |
149 -12,8 -29,9 (-50,7, -9,1) |
163 -24,9 -42,0 (-63,0, -20,9) |
156 -18,9 -35,9 (-54,2, -17,6) |
|
16. Como é fornecido o Trulicity
16.1 Como é fornecido
A injeção de TRULICITY (dulaglutida) é uma solução límpida e incolor fornecida em canetas unidose. TRULICITY é embalado em uma caixa externa de papelão contendo 4 canetas TRULICITY de dose única e é fornecido da seguinte forma:
| Força Total por Volume Total | CDN |
| 0,75 mg/0,5 mL | NDC 0002-1433-80 |
| 1,5 mg/0,5 mL | NDC 0002-1434-80 |
| 3 mg/0,5 mL | NDC 0002-2236-80 |
| 4,5 mg/0,5 mL | NDC 0002-3182-80 |
16.2 Armazenamento e Manuseio
- Armazene TRULICITY na geladeira entre 2 ° C e 8 ° C (36 ° F a 46 ° F).
- Se necessário, cada caneta de dose única pode ser mantida à temperatura ambiente, não excedendo 30°C (86°F) durante um total de 14 dias.
- Não congele TRULICIDADE. Não use TRULICITY se estiver congelado.
- Proteja TRULICITY da luz. O armazenamento de TRULICITY na embalagem original é recomendado até o momento da administração.
17. Informações de aconselhamento ao paciente
Aconselhe o paciente a ler a rotulagem do paciente aprovada pela FDA (Guia de medicação e instruções de uso).
- Informe os pacientes que TRULICITY causa tumores benignos e malignos de células C da tireoide em ratos e que a relevância humana deste achado não foi determinada. Aconselhe os pacientes a relatar sintomas de tumores da tireoide (por exemplo, um caroço no pescoço, rouquidão persistente, disfagia ou dispneia) ao seu médico.
- Informe os pacientes que a dor abdominal intensa e persistente, que pode irradiar para as costas e que pode (ou não) ser acompanhada de vômito, é o sintoma característico da pancreatite aguda. Instrua os pacientes a descontinuar TRULICITY imediatamente e a entrar em contato com seu médico, se ocorrer dor abdominal intensa e persistente.
- Informe os pacientes que o risco de hipoglicemia pode aumentar quando TRULICITY é usado em combinação com um secretagogo de insulina (como uma sulfonilureia) ou insulina. Educar os pacientes sobre os sinais e sintomas de hipoglicemia.
- Aconselhe os pacientes sobre o risco potencial de desidratação devido a reações adversas gastrointestinais e tome precauções para evitar a depleção de líquidos. Informar os pacientes tratados com TRULICITY sobre o risco potencial de piora da função renal e explicar os sinais e sintomas associados de insuficiência renal, bem como a possibilidade de diálise como intervenção médica se ocorrer insuficiência renal.
- Informe os pacientes que foram relatadas reações graves de hipersensibilidade com o uso de TRULICITY. Aconselhe os pacientes sobre os sintomas de reações de hipersensibilidade e instrua-os a parar de tomar TRULICITY e procurar aconselhamento médico imediatamente se tais sintomas ocorrerem.
- Informe os pacientes para entrar em contato com seu médico se ocorrerem alterações na visão durante o tratamento com TRULICITY.
- Informe os pacientes sobre o risco potencial de colelitíase ou colecistite. Instrua os pacientes a entrar em contato com seu médico se houver suspeita de colelitíase ou colecistite para acompanhamento clínico apropriado.
- Aconselhe as pacientes a informarem seu médico se estiverem grávidas ou pretenderem engravidar.
- Informe os pacientes se uma dose for esquecida e faltarem pelo menos 3 dias (72 horas) até a próxima dose programada, eles devem administrá-la o mais rápido possível e depois retomar o esquema posológico habitual uma vez por semana. Se uma dose for esquecida e a próxima dose regularmente programada for prevista em 1 ou 2 dias, informe o paciente para não administrar a dose esquecida e, em vez disso, retomar TRULICITY com a próxima dose regularmente programada.
- Aconselhe os pacientes tratados com TRULICITY sobre o risco potencial de efeitos colaterais gastrointestinais.
Guia de medicação
| Guia de medicação TRULICIDADE® (TRU-li-si-tee) (dulaglutida) injeção, para uso subcutâneo |
|||
| Leia este Guia de Medicamentos antes de começar a usar TRULICITY e sempre que receber uma recarga. Pode haver novas informações. Estas informações não substituem uma conversa com seu médico sobre sua condição médica ou tratamento. | |||
| Qual é a informação mais importante que devo saber sobre TRULICITY? TRULICITY pode causar efeitos colaterais graves, incluindo:
|
|||
O que é TRULICIDADE?
|
|||
Não use TRULICITY se:
|
|||
Antes de usar TRULICITY, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
|
|||
| Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos com e sem prescrição, vitaminas e suplementos de ervas. TRULICITY pode afetar a forma como alguns medicamentos atuam e alguns medicamentos podem afetar a forma como TRULICITY atua. Antes de usar TRULICITY, informe o seu médico se estiver tomando outros medicamentos para tratar o diabetes, incluindo insulina ou sulfonilureias, que podem aumentar o risco de níveis baixos de açúcar no sangue. Converse com seu médico sobre níveis baixos de açúcar no sangue e como controlá-los. Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando você adquirir um novo medicamento. |
|||
Como devo usar o TRULICITY?
|
|||
| Quais são os possíveis efeitos colaterais do TRULICITY? TRULICITY pode causar efeitos colaterais graves, incluindo:
|
|||
|
|
|
|
|
|||
|
|
||
|
|||
|
|
||
| Os efeitos colaterais mais comuns de TRULICITY podem incluir: | |||
|
|
||
| Informe o seu médico se você tiver algum efeito colateral que o incomode ou que não desapareça. Estes não são todos os possíveis efeitos colaterais do TRULICITY. Ligue para seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA pelo telefone 1-800-FDA-1088. |
|||
| Informações gerais sobre o uso seguro e eficaz de TRULICITY. Às vezes, os medicamentos são prescritos para fins diferentes daqueles listados no Guia de Medicamentos. Não use TRULICITY para uma condição para a qual não foi prescrito. Não dê TRULICITY a outras pessoas, mesmo que elas apresentem os mesmos sintomas que você. Isso pode prejudicá-los. Este Guia de Medicamentos resume as informações mais importantes sobre TRULICITY. Se desejar mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre o TRULICITY escrito para profissionais de saúde. |
|||
| Quais são os ingredientes do TRULICIDADE? Ingrediente ativo: dulaglutida Ingredientes inativos: ácido cítrico anidro, manitol, polissorbato 80, citrato trissódico di-hidratado, em água para preparações injetáveis TRULICIDADE® é uma marca registrada da Eli Lilly and Company. Para obter mais informações, acesse www.TRULICITY.com |
|||
TRULICITY 0,75 MG CANETA ÚNICA INSTRUÇÕES DE USO
| Instruções de uso | ||
| TRULICIDADE® (TRU-li-si-tee) (dulaglutida) injeção, para uso subcutâneo Caneta de dose única de 0,75 mg/0,5 mL use 1 vez por semana (uma vez por semana) |
||
 |
||
 |
||
 |
||
| Informações sobre a caneta de dose única TRULICITY Por favor, leia estas instruções de uso e o Guia de Medicamentos cuidadosa e completamente antes de usar sua caneta de dose única TRULICITY. Converse com seu médico sobre como injetar TRULICITY da maneira certa.
Você pode marcar seu calendário para lembrá-lo de quando tomar a próxima dose. |
||
| Antes de começar | |||
 |
 |
 |
 |
| Remover | Verificar | Inspecionar | Preparar |
| Retire a caneta da geladeira. Deixe a tampa da base colocada até estar pronto para injetar. |
Verifique o rótulo da caneta para ter certeza de que você tem o medicamento correto e que ele não expirou. |
Verifique a caneta para ter certeza de que não está danificada e inspecione o medicamento para se certificar de que não está turvo, descolorido ou contém partículas. | Lave as mãos. |
| Escolha o seu local de injeção | |||
| Seu médico pode ajudá-lo a escolher o local de injeção melhor para você. | |||
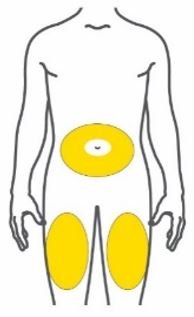 |
Mude (rode) o local da injeção todas as semanas. Você pode usar a mesma área do corpo, mas certifique-se de escolher um local de injeção diferente nessa área.Você pode injetar o medicamento no estômago (abdômen) ou na coxa. |
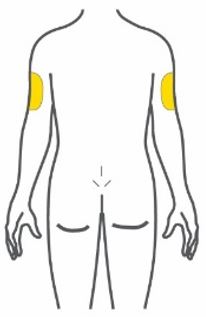 |
Outra pessoa deve administrar a injeção na parte de trás do braço. |
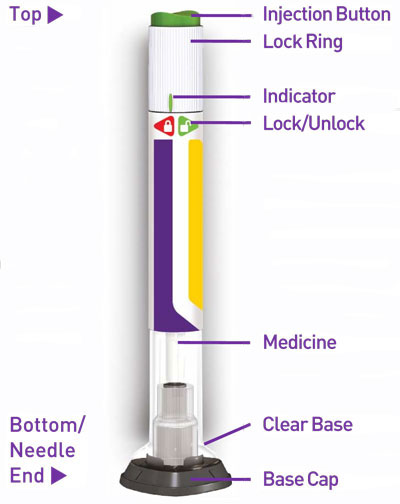 |
|
Etapa 1: destampe a caneta Certifique-se de que a caneta esteja bloqueado. Certifique-se de que a caneta esteja bloqueado.
|
 |
Passo 2 Coloque e desbloqueie
|
 |
Etapa 3 Pressione e segure
|
 Você saberá que a injeção foi concluída quando o êmbolo cinza estiver visível. |
| Informação importante Descarte de caneta Armazenamento e Manuseio Perguntas mais frequentes Outra informação Onde aprender mais |
|||
Descarte de suas canetas usadas
|
 |
||
| Armazenamento e Manuseio | |||
|
|||
| Perguntas mais frequentes | |||
| E se eu vir bolhas de ar na minha caneta? Bolhas de ar são normais. E se eu desbloquear a caneta e pressionar o botão de injeção verde antes de retirar a tampa da base? Não remova a tampa da base. Jogue fora a caneta e compre uma caneta nova. E se houver uma gota de líquido na ponta da agulha quando eu remover a tampa da base? Uma gota de líquido na ponta da agulha é normal. Preciso manter pressionado o botão de injeção até que a injeção seja concluída? Isto não é necessário, mas pode ajudá-lo a manter a caneta firme e firme contra a pele. Ouvi mais de 2 cliques durante a injeção – 2 cliques mais altos e 1 suave. Recebi minha injeção completa? Alguns pacientes podem ouvir um clique suave logo antes do segundo clique alto. Essa é a operação normal da caneta. Não remova a caneta da pele até ouvir o segundo clique mais alto. E se houver uma gota de líquido ou sangue na minha pele após a injeção? Isto é normal. Não tenho certeza se minha caneta funcionou da maneira certa. Verifique se você recebeu sua dose. A sua dose foi administrada da forma correta se o êmbolo cinzento estiver visível (veja a etapa 3). Entre em contato também com a Lilly pelo telefone 1-800-Lilly-Rx (1-800-545-5979) para obter mais instruções. Até então, guarde sua caneta com segurança para evitar picadas acidentais com a agulha. |
|||
| Outra informação | |||
|
|||
| Onde aprender mais | |||
|
|||
 |
VERIFIQUE ESTE CÓDIGO PARA LANÇAR www.trulicity.com |
||
|
Direitos autorais © 2014, 2022, Eli Lilly and Company. Todos os direitos reservados.
A caneta TRULICITY atende aos atuais requisitos funcionais e de precisão de dose da ISO 11608-1:2012 e 11608-5:2012. TRULOAI-0004-IFU-20221117 |
|||
TRULICITY 1.5 MG CANETA ÚNICA INSTRUÇÕES DE USO
| Antes de começar | ||||
 |
 |
 |
 |
|
| Remover | Verificar | Inspecionar | Preparar | |
| Retire a caneta da geladeira. Deixe a tampa da base colocada até estar pronto para injetar. |
Verifique o rótulo da caneta para ter certeza de que você tem o medicamento correto e que ele não expirou. |
Verifique a caneta para ter certeza de que não está danificada e inspecione o medicamento para se certificar de que não está turvo, descolorido ou contém partículas. | Lave as mãos. | |
| Escolha o seu local de injeção | ||||
| Seu médico pode ajudá-lo a escolher o local de injeção mais adequado para você. | ||||
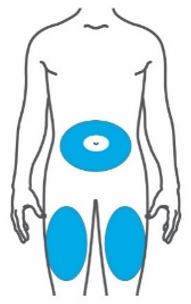 |
Mude (rode) o local da injeção todas as semanas. Você pode usar a mesma área do corpo, mas certifique-se de escolher um local de injeção diferente nessa área.Você pode injetar o medicamento no estômago (abdômen) ou na coxa. |
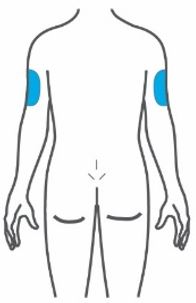 |
Outra pessoa deve administrar a injeção na parte de trás do braço. |
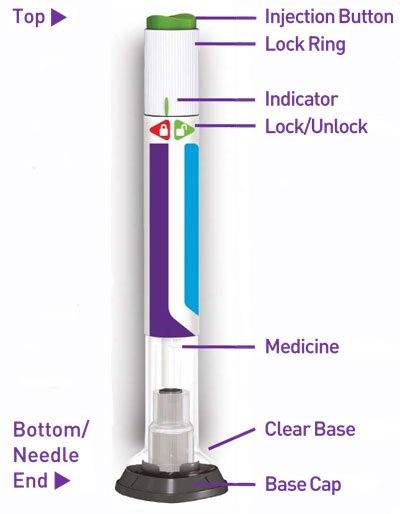 |
Etapa 1: destampe a caneta Certifique-se de que a caneta esteja bloqueado. Certifique-se de que a caneta esteja bloqueado.
|
 |
Passo 2 Coloque e desbloqueie
|
 |
Etapa 3 Pressione e segure
|
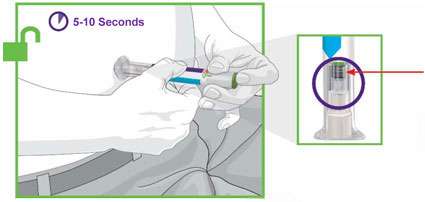 Você saberá que a injeção foi concluída quando o êmbolo cinza estiver visível. |
| Informação importante Descarte de caneta Armazenamento e Manuseio Perguntas mais frequentes Outra informação Onde aprender mais |
|
Descarte de suas canetas usadas
|
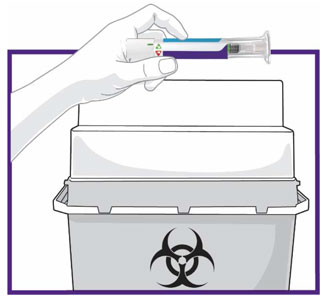 |
| Armazenamento e Manuseio |
|
| Perguntas mais frequentes | ||
| E se eu vir bolhas de ar na minha caneta? Bolhas de ar são normais. E se eu desbloquear a caneta e pressionar o botão de injeção verde antes de retirar a tampa da base? Não remova a tampa da base. Jogue fora a caneta e compre uma caneta nova. E se houver uma gota de líquido na ponta da agulha quando eu remover a tampa da base? Uma gota de líquido na ponta da agulha é normal. Preciso manter pressionado o botão de injeção até que a injeção seja concluída? Isto não é necessário, mas pode ajudá-lo a manter a caneta firme e firme contra a pele. Ouvi mais de 2 cliques durante a injeção – 2 cliques mais altos e 1 suave. Recebi minha injeção completa? Alguns pacientes podem ouvir um clique suave logo antes do segundo clique alto. Essa é a operação normal da caneta. Não remova a caneta da pele até ouvir o segundo clique mais alto. E se houver uma gota de líquido ou sangue na minha pele após a injeção? Isto é normal. Não tenho certeza se minha caneta funcionou da maneira certa. Verifique se você recebeu sua dose. A sua dose foi administrada da forma correta se o êmbolo cinzento estiver visível (veja a etapa 3). Entre em contato também com a Lilly pelo telefone 1-800-Lilly-Rx (1-800-545-5979) para obter mais instruções. Até então, guarde sua caneta com segurança para evitar picadas acidentais com a agulha. |
||
| Outra informação | ||
|
||
| Onde aprender mais | ||
|
||
 |
VERIFIQUE ESTE CÓDIGO PARA LANÇAR www.trulicity.com |
|
TRULICITY 3 MG INSTRUÇÕES DE USO DA CANETA ÚNICA
Informações sobre a caneta de dose única TRULICITY
Por favor, leia estas instruções de uso e o Guia de Medicamentos cuidadosa e completamente antes de usar sua caneta de dose única TRULICITY. Converse com seu médico sobre como injetar TRULICITY da maneira certa.
- A caneta de dose única TRULICITY (caneta) é um dispositivo descartável e pré-cheio para administração de medicamentos. Cada caneta contém 1 dose de TRULICITY (3 mg/0,5 mL). Cada caneta só deve ser usada 1 vez.
- TRULICITY é usado 1 vez por semana. Você pode marcar seu calendário para lembrá-lo de quando tomar a próxima dose.
Antes de começar
 |
 |
 |
 |
| Remover | Verificar | Inspecionar | Preparar |
| Retire a caneta da geladeira. Deixe a tampa da base colocada até estar pronto para injetar. |
Verifique o rótulo da caneta para ter certeza de que você tem o medicamento correto e que ele não expirou. Data de validade  |
Verifique a caneta para se certificar de que não está danificada e inspecione o medicamento para se certificar de que não está turvo, descolorido ou contém partículas. | Lave as mãos. |
Escolha o seu local de injeção
Seu médico pode ajudá-lo a escolher o local de injeção melhor para você.
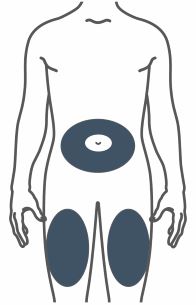 |
Mude (rode) o local da injeção todas as semanas. Você pode usar a mesma área do corpo, mas certifique-se de escolher um local de injeção diferente nessa área.Você pode injetar o medicamento no estômago (abdômen) ou na coxa. |
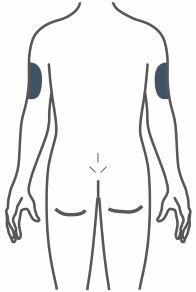 |
Outra pessoa deve administrar a injeção na parte de trás do braço. |
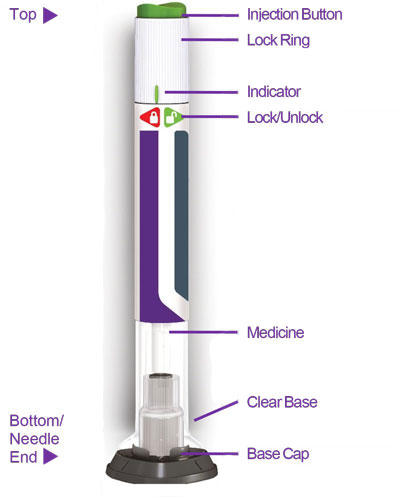
Etapa 1: destampe a caneta Certifique-se de que a caneta esteja bloqueado. Certifique-se de que a caneta esteja bloqueado.
|
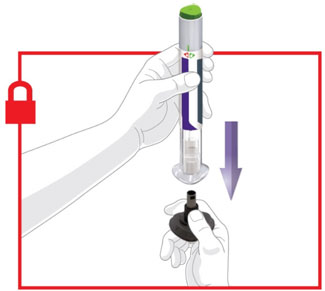 |
Passo 2 Coloque e desbloqueie
|
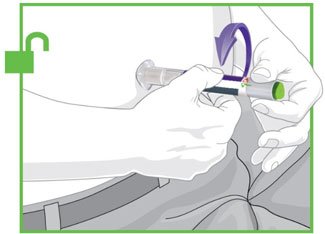 |
Etapa 3 Pressione e segure
|
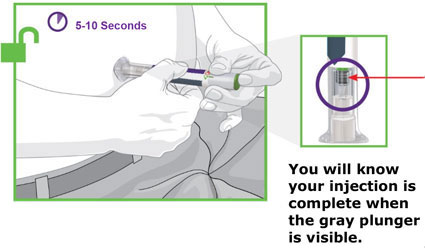 |
|
Informação importante
Descarte de caneta
Armazenamento e Manuseio
Perguntas mais frequentes
Outra informação
Onde aprender mais
Descarte de suas canetas usadas
|
 |
Armazenamento e Manuseio
- Guarde sua caneta na geladeira entre 2 ° C e 8 ° C (36 ° F a 46 ° F).
- Você pode armazenar sua caneta em temperatura ambiente abaixo de 30°C (86°F) por um total de 14 dias.
- Não congele sua caneta. Se a caneta estiver congelada, jogue-a fora e use uma caneta nova.
- Recomenda-se o armazenamento da sua caneta na embalagem original. Proteja sua caneta do calor e da luz diretos.
- A caneta possui partes de vidro. Manuseie-o com cuidado. Se você deixá-lo cair em uma superfície dura, não o use. Utilize uma caneta nova para a sua injeção.
- Mantenha sua caneta TRULICITY e todos os medicamentos fora do alcance das crianças.
Perguntas mais frequentes
E se eu vir bolhas de ar na minha caneta?
Bolhas de ar são normais.
E se eu desbloquear a caneta e pressionar o botão de injeção verde antes de retirar a tampa da base?
Não remova a tampa da base. Jogue fora a caneta e compre uma caneta nova.
E se houver uma gota de líquido na ponta da agulha quando eu remover a tampa da base?
Uma gota de líquido na ponta da agulha é normal.
Preciso manter pressionado o botão de injeção até que a injeção seja concluída?
Isto não é necessário, mas pode ajudá-lo a manter a caneta firme e firme contra a pele.
Ouvi mais de 2 cliques durante a injeção – 2 cliques mais altos e 1 suave. Recebi minha injeção completa?
Algumas pessoas podem ouvir um clique suave logo antes do segundo clique alto. Essa é a operação normal da caneta. Não remova a caneta da pele até ouvir o segundo clique mais alto.
E se houver uma gota de líquido ou sangue na minha pele após a injeção?
T o dele é normal.
Não tenho certeza se minha caneta funcionou da maneira certa.
Verifique se você recebeu sua dose. A sua dose foi administrada da forma correta se o êmbolo cinzento estiver visível (veja a etapa 3). Entre em contato também com a Lilly pelo telefone 1-800-Lilly-Rx (1-800-545-5979) para obter mais instruções. Até então, guarde sua caneta com segurança para evitar picadas acidentais com a agulha.
Outra informação
- Se você tiver problemas de visão, não use sua caneta sem a ajuda de uma pessoa treinada para usar a caneta TRULICITY.
Onde aprender mais
- Se você tiver alguma dúvida ou problema com sua caneta de dose única TRULICITY, entre em contato com a Lilly pelo telefone 1-800-Lilly-Rx (1-800-545-5979) ou ligue para seu médico.
- Para obter mais informações sobre a caneta de dose única TRULICITY, visite nosso website em: www.trulicity.com.
 |
Digitalize este código para iniciar www.trulicity.com |
Estas instruções de uso foram aprovadas pela Food and Drug Administration dos EUA.
Eli Lilly e Companhia
Indianápolis, IN 46285, EUA
Número de licença dos EUA 1891
TRULICITY é uma marca registrada da Eli Lilly and Company.
Direitos autorais © 2020, 2023, Eli Lilly and Company. Todos os direitos reservados.
A caneta TRULICITY atende aos atuais requisitos funcionais e de precisão de dose da ISO 11608-1:2012 e 11608-5:2012.
Implementado: 04/2023
TRU3MG-0002-IFU-20230407
TRULICITY 4,5 MG CANETA ÚNICA INSTRUÇÕES DE USO
| Instruções de uso | ||
| TRULICIDADE®(TRU-li-si-tee) (dulaglutida) injeção, para uso subcutâneo Caneta de dose única de 4,5 mg/0,5 mL use 1 vez por semana (uma vez por semana) 
|
||
 |
Informações sobre a caneta de dose única TRULICITY
Por favor, leia estas instruções de uso e o Guia de Medicamentos cuidadosa e completamente antes de usar sua caneta de dose única TRULICITY. Converse com seu médico sobre como injetar TRULICITY da maneira certa.
- A caneta de dose única TRULICITY (caneta) é um dispositivo descartável e pré-cheio para administração de medicamentos. Cada caneta contém 1 dose de TRULICITY (4,5 mg/0,5 mL). Cada caneta só deve ser usada 1 vez.
- TRULICITY é usado 1 vez por semana. Você pode marcar seu calendário para lembrá-lo de quando tomar a próxima dose.
Antes de começar
 |
 |
 |
 |
| Remover | Verificar | Inspecionar | Preparar |
| Retire a caneta da geladeira. Deixe a tampa da base colocada até estar pronto para injetar. |
Verifique o rótulo da caneta para ter certeza de que você tem o medicamento correto e que ele não expirou. Data de validade  |
Verifique a caneta para se certificar de que não está danificada e inspecione o medicamento para se certificar de que não está turvo, descolorido ou contém partículas. | Lave as mãos. |
Escolha o seu local de injeção
Seu médico pode ajudá-lo a escolher o local de injeção melhor para você.
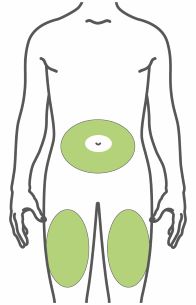 |
Mude (rode) o local da injeção todas as semanas. Você pode usar a mesma área do corpo, mas certifique-se de escolher um local de injeção diferente nessa área.Você pode injetar o medicamento no estômago (abdômen) ou na coxa. |
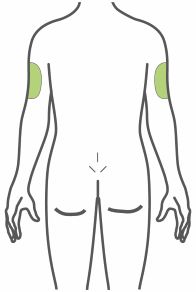 |
Outra pessoa deve administrar a injeção na parte de trás do braço. |
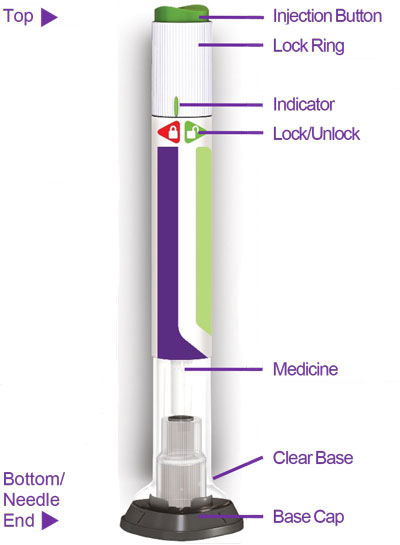
Etapa 1: destampe a caneta Certifique-se de que a caneta esteja bloqueado. Certifique-se de que a caneta esteja bloqueado.
|
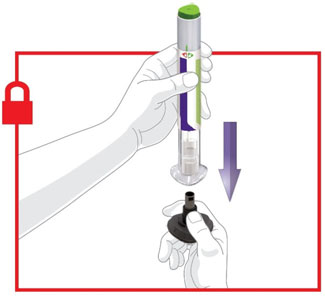 |
|
Passo 2 Coloque e desbloqueie
|
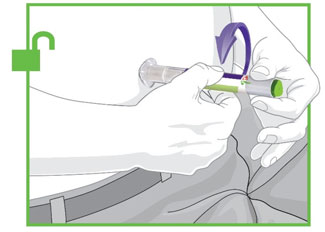 |
|
Etapa 3 Pressione e segure
|
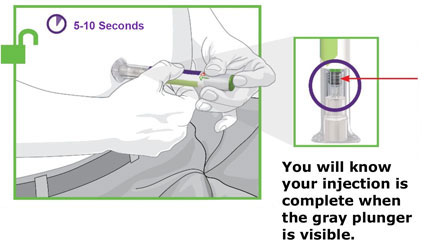 |
||
Informação importante
Descarte de caneta
Armazenamento e Manuseio
Perguntas mais frequentes
Outra informação
Onde aprender mais
Descarte de suas canetas usadas
|
 |
Armazenamento e Manuseio
- Guarde sua caneta na geladeira entre 2 ° C e 8 ° C (36 ° F a 46 ° F).
- Você pode armazenar sua caneta em temperatura ambiente abaixo de 30°C (86°F) por um total de 14 dias.
- Não congele sua caneta. Se a caneta estiver congelada, jogue-a fora e use uma caneta nova.
- Recomenda-se o armazenamento da sua caneta na embalagem original. Proteja sua caneta do calor e da luz diretos.
- A caneta possui partes de vidro. Manuseie-o com cuidado. Se você deixá-lo cair em uma superfície dura, não o use. Utilize uma caneta nova para a sua injeção.
- Mantenha sua caneta TRULICITY e todos os medicamentos fora do alcance das crianças.
Perguntas mais frequentes
E se eu vir bolhas de ar na minha caneta?
Bolhas de ar são normais.
E se eu desbloquear a caneta e pressionar o botão de injeção verde antes de retirar a tampa da base?
Não remova a tampa da base. Jogue fora a caneta e compre uma caneta nova.
E se houver uma gota de líquido na ponta da agulha quando eu remover a tampa da base?
Uma gota de líquido na ponta da agulha é normal.
Preciso manter pressionado o botão de injeção até que a injeção seja concluída?
Isto não é necessário, mas pode ajudá-lo a manter a caneta firme e firme contra a pele.
Ouvi mais de 2 cliques durante a injeção – 2 cliques mais altos e 1 suave. Recebi minha injeção completa?
Algumas pessoas podem ouvir um clique suave logo antes do segundo clique alto. Essa é a operação normal da caneta. Não remova a caneta da pele até ouvir o segundo clique mais alto.
E se houver uma gota de líquido ou sangue na minha pele após a injeção?
Isto é normal.
Não tenho certeza se minha caneta funcionou da maneira certa.
Verifique se você recebeu sua dose. A sua dose foi administrada da forma correta se o êmbolo cinzento estiver visível (veja a etapa 3). Entre em contato também com a Lilly pelo telefone 1-800-Lilly-Rx (1-800-545-5979) para obter mais instruções. Até então, guarde sua caneta com segurança para evitar picadas acidentais com a agulha.
Outra informação
- Se você tiver problemas de visão, não use sua caneta sem a ajuda de uma pessoa treinada para usar a caneta TRULICITY.
Onde aprender mais
- Se você tiver alguma dúvida ou problema com sua caneta de dose única TRULICITY, entre em contato com a Lilly pelo telefone 1-800-Lilly-Rx (1-800-545-5979) ou ligue para seu médico.
- Para obter mais informações sobre a caneta de dose única TRULICITY, visite nosso website em: www.trulicity.com.
 |
Digitalize este código para iniciar www.trulicity.com |

 Desbloquear girando o anel de travamento.
Desbloquear girando o anel de travamento. Continue segurando a Base Transparente firmemente contra a pele até ouvir um segundo clique. Isso acontece quando a agulha começa a retrair em cerca de 5 a 10 segundos.
Continue segurando a Base Transparente firmemente contra a pele até ouvir um segundo clique. Isso acontece quando a agulha começa a retrair em cerca de 5 a 10 segundos.