Bula/rótulo do produto
Nome genérico: insulina degludeca
Forma farmacêutica: injeção, solução
Classe de drogas: Insulina
1. Indicações e uso de Tresiba
TRESIBA é indicado para melhorar o controle glicêmico em pacientes com 1 ano de idade ou mais com diabetes mellitus.
Limitações de uso
- •
- Não recomendado para o tratamento da cetoacidose diabética.
2. Dosagem e administração de Tresiba
2.1 Instruções Importantes de Administração
- •
- Sempre verifique os rótulos da insulina antes da administração.
- •
- Inspecione visualmente quanto a partículas e descoloração. Utilize TRESIBA apenas se a solução parecer límpida e incolor.
- •
- Injete TRESIBA por via subcutânea na coxa, braço ou abdômen.
- •
- Alterne os locais de injeção na mesma região de uma injeção para outra para reduzir o risco de lipodistrofia e amiloidose cutânea localizada. Não injetar em áreas de lipodistrofia ou amiloidose cutânea localizada.
- •
- Durante alterações no regime de insulina de um paciente, aumentar a frequência do monitoramento da glicemia.
- •
- Para pacientes pediátricos que necessitam de menos de 5 unidades de TRESIBA por dia, use o frasco para injetáveis de TRESIBA U-100.
- •
- NÃO administre TRESIBA por via intravenosa ou em uma bomba de infusão de insulina.
- •
- NÃO dilua ou misture TRESIBA com qualquer outra insulina ou solução.
- •
- NÃO transfira TRESIBA da caneta TRESIBA FlexTouch para uma seringa para administração.
- •
- Use canetas TRESIBA FlexTouch com cautela em pacientes com deficiência visual que podem contar com cliques audíveis para marcar a dose.
2.2 Instruções Gerais de Dosagem
- •
- TRESIBA está disponível em 2 concentrações (U-100 e U-200):
- ó
- TRESIBA U-100 está disponível como caneta FlexTouch para uso em um único paciente e frasco para injetáveis de doses múltiplas.
- ▪
- A caneta FlexTouch administra doses em incrementos de 1 unidade e pode administrar até 80 unidades em uma única injeção.
- ó
- TRESIBA U-200 está disponível como uma caneta FlexTouch para uso em um único paciente.
- ▪
- A caneta FlexTouch administra doses em incrementos de 2 unidades e pode administrar até 160 unidades em uma única injeção.
- •
- NÃO realize conversão de dose ao usar as canetas TRESIBA U-100 ou U-200 FlexTouch. A janela posológica mostra o número de unidades de insulina a serem administradas e não é necessária qualquer conversão.
- •
- Em adultos, injete TRESIBA por via subcutânea uma vez ao dia a qualquer hora do dia.
- •
- Em pacientes pediátricos, injetar TRESIBA por via subcutânea uma vez ao dia, no mesmo horário, todos os dias.
- •
- Individualizar e titular a dose de TRESIBA com base nas necessidades metabólicas do paciente, nos resultados do monitoramento da glicemia e na meta de controle glicêmico.
- •
- Os dias recomendados entre aumentos de dose são de 3 a 4 dias.
- •
- Podem ser necessários ajustes de dose com alterações na atividade física, alterações nos padrões de refeição (ou seja, conteúdo de macronutrientes ou horário de ingestão de alimentos), alterações na função renal ou hepática ou durante doença aguda para minimizar o risco de hipoglicemia ou hiperglicemia.
- •
- Para pacientes adultos, instrua os pacientes que perderam uma dose de TRESIBA a injetar sua dose diária durante as horas de vigília ao descobrirem a dose esquecida. Instrua os pacientes a garantir que tenham decorrido pelo menos 8 horas entre injeções consecutivas de TRESIBA.
- •
- Para pacientes pediátricos, instrua os pacientes que esquecerem de uma dose de TRESIBA a entrar em contato com seu médico para obter orientação e monitorar os níveis de glicose no sangue com mais frequência até a próxima dose programada de TRESIBA.
- •
- Em pacientes com diabetes tipo 1, TRESIBA deve ser utilizado concomitantemente com insulina de ação curta.
2.3 Dose inicial em pacientes virgens de insulina
Dosagem inicial recomendada em pacientes com diabetes mellitus tipo 1:
A dose inicial recomendada de TRESIBA em pacientes com diabetes tipo 1 sem tratamento prévio com insulina é de aproximadamente um terço a metade da dose diária total de insulina. O restante da dose diária total de insulina deve ser administrado como insulina de ação curta e dividido entre cada refeição diária. Como regra geral, 0,2 a 0,4 unidades de insulina por quilograma de peso corporal podem ser usadas para calcular a dose diária total inicial de insulina em pacientes virgens de insulina com diabetes tipo 1.
Dosagem inicial recomendada em pacientes com diabetes mellitus tipo 2:
A dose inicial recomendada de TRESIBA em pacientes com diabetes mellitus tipo 2 sem tratamento prévio com insulina é de 10 unidades uma vez ao dia.
2.4 Mudando para TRESIBA de outras terapias com insulina
Ajustes de dose são recomendados para diminuir o risco de hipoglicemia ao mudar os pacientes de outra terapia com insulina para Insulina Degludec.
Adultos com Diabetes Mellitus Tipo 1 ou Tipo 2:
Inicie TRESIBA na mesma dose unitária da dose unitária diária total de insulina de ação longa ou intermediária.
Pacientes pediátricos com 1 ano de idade ou mais com diabetes mellitus tipo 1 ou tipo 2:
Iniciar TRESIBA com 80% da dose unitária diária total de insulina de ação prolongada ou intermediária para minimizar o risco de hipoglicemia.
3. Formas farmacêuticas e dosagens
Injeção: Disponível como solução límpida e incolor:
- •
- 100 unidades/mL (U-100): caneta pré-cheia FlexTouch de uso único de 3 mL
- •
- 100 unidades/mL (U-100): frasco para injetáveis de dose múltipla de 10 mL
- •
- 200 unidades/mL (U-200): caneta pré-cheia FlexTouch de uso único de 3 mL
4. Contra-indicações
TRESIBA está contra-indicado:
- •
- Durante episódios de hipoglicemia.
- •
- Em pacientes com hipersensibilidade à insulina degludec ou a qualquer um dos excipientes de TRESIBA.
5. Advertências e precauções
5.1 Nunca compartilhe uma caneta, agulha ou seringa de insulina TRESIBA FlexTouch entre pacientes
As canetas pré-cheias descartáveis TRESIBA FlexTouch nunca devem ser compartilhadas entre pacientes, mesmo que a agulha seja trocada. Os pacientes que usam frascos para injetáveis de TRESIBA nunca devem compartilhar agulhas ou seringas com outra pessoa. O compartilhamento representa um risco de transmissão de patógenos transmitidos pelo sangue.
5.2 Hiperglicemia ou Hipoglicemia com Alterações no Regime de Insulina
Mudanças no regime de insulina (por exemplo, dosagem da insulina, fabricante, tipo, local de injeção ou método de administração) podem afetar o controle glicêmico e predispor à hipoglicemia ou hiperglicemia. Foi relatado que injeções repetidas de insulina em áreas de lipodistrofia ou amiloidose cutânea localizada resultam em hiperglicemia; e foi relatado que uma mudança repentina no local da injeção (para uma área não afetada) resultou em hipoglicemia.
Faça quaisquer alterações no regime de insulina do paciente sob supervisão médica rigorosa e com maior frequência de monitoramento da glicose no sangue. Aconselhe os pacientes que injetaram repetidamente em áreas de lipodistrofia ou amiloidose cutânea localizada a mudar o local da injeção para áreas não afetadas e monitorar de perto a hipoglicemia. Para pacientes com diabetes tipo 2, podem ser necessários ajustes no tratamento antidiabético concomitante.
5.3 Hipoglicemia
A hipoglicemia é a reação adversa mais comum da insulina, incluindo TRESIBA. A hipoglicemia grave pode causar convulsões, ser fatal ou causar a morte. A hipoglicemia pode prejudicar a capacidade de concentração e o tempo de reação; isso pode colocar o paciente e outras pessoas em risco em situações em que essas habilidades são importantes (por exemplo, dirigir ou operar outras máquinas). TRESIBA, ou qualquer insulina, não deve ser utilizado durante episódios de hipoglicemia.
A hipoglicemia pode ocorrer repentinamente e os sintomas podem diferir em cada paciente e mudar ao longo do tempo no mesmo paciente. A consciência sintomática da hipoglicemia pode ser menos pronunciada em pacientes com diabetes de longa data, em pacientes com neuropatia diabética, em uso de medicamentos que bloqueiam o sistema nervoso simpático (por exemplo, betabloqueadores), ou que apresentam hipoglicemia recorrente.
O efeito de ação prolongada de TRESIBA pode atrasar a recuperação da hipoglicemia em comparação com as insulinas de ação mais curta.
Fatores de risco para hipoglicemia
O risco de hipoglicemia geralmente aumenta com a intensidade do controle glicêmico. O risco de hipoglicemia após uma injeção está relacionado à duração da ação da insulina e, em geral, é mais elevado quando o efeito redutor da glicose da insulina é máximo. Tal como acontece com todas as insulinas, o tempo de duração do efeito de redução da glicose de TRESIBA pode variar entre diferentes pacientes ou em momentos diferentes nos mesmos pacientes e depende de muitas condições, incluindo a área de injeção, bem como o suprimento sanguíneo e a temperatura no local da injeção.
Outros fatores que podem aumentar o risco de hipoglicemia incluem alterações no padrão alimentar (por exemplo, conteúdo de macronutrientes ou horário das refeições), alterações no nível de atividade física ou alterações nos medicamentos concomitantes. Pacientes com insuficiência renal ou hepática podem apresentar maior risco de hipoglicemia.
Estratégias de mitigação de risco para hipoglicemia
Pacientes e cuidadores devem ser educados para reconhecer e controlar a hipoglicemia. O automonitoramento da glicemia desempenha um papel essencial na prevenção e no manejo da hipoglicemia. Em pacientes com maior risco de hipoglicemia e pacientes com consciência sintomática reduzida de hipoglicemia, recomenda-se aumento da frequência de monitoramento da glicemia.
5.4 Hipoglicemia devido a erros de medicação
Foram relatadas confusões acidentais entre produtos de insulina. Para evitar erros de medicação entre TRESIBA e outras insulinas, instrua os pacientes a sempre verificarem o rótulo da insulina antes de cada injeção.
Para evitar erros de dosagem e possível sobredosagem, nunca utilize uma seringa para remover TRESIBA da caneta pré-cheia de insulina descartável TRESIBA FlexTouch.
5.5 Reações de hipersensibilidade
Alergia generalizada grave, com risco de vida, incluindo anafilaxia, pode ocorrer com insulinas, incluindo TRESIBA. Se ocorrerem reações de hipersensibilidade, interrompa TRESIBA; trate de acordo com o padrão de atendimento e monitore até que os sintomas e sinais desapareçam. TRESIBA está contra-indicado em pacientes que tiveram reações de hipersensibilidade à insulina degludec ou a qualquer um dos excipientes.
5.6 Hipocalemia
Todas as insulinas, incluindo TRESIBA, causam uma mudança no potássio do espaço extracelular para o espaço intracelular, possivelmente levando à hipocalemia. A hipocalemia não tratada pode causar paralisia respiratória, arritmia ventricular e morte. Monitore os níveis de potássio em pacientes com risco de hipocalemia, se indicado (por exemplo, pacientes em uso de medicamentos redutores de potássio, pacientes que tomam medicamentos sensíveis às concentrações séricas de potássio).
5.7 Retenção de líquidos e insuficiência cardíaca congestiva com uso concomitante de um agonista gama PPAR
As tiazolidinedionas (TZDs), que são agonistas gama do receptor ativado por proliferador de peroxissoma (PPAR), podem causar retenção de líquidos relacionada à dose, quando usadas em combinação com insulina. A retenção de líquidos pode causar ou agravar a insuficiência cardíaca congestiva. Os pacientes tratados com insulina, incluindo TRESIBA e um agonista do PPAR-gama, devem ser observados quanto a sinais e sintomas de insuficiência cardíaca congestiva. Se ocorrer insuficiência cardíaca congestiva, esta deve ser tratada de acordo com os padrões atuais de cuidados e deve ser considerada a descontinuação ou redução da dose do agonista do PPAR-gama.
6. Reações adversas/efeitos colaterais
As seguintes reações adversas também são discutidas em outro lugar:
- •
- Hipoglicemia
- •
- Hipoglicemia devido a erros de medicação
- •
- Reações de hipersensibilidade
- •
- Hipocalemia
6.1 Experiência em Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as reações adversas as taxas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
A segurança de TRESIBA em indivíduos com diabetes tipo 1 ou diabetes tipo 2 foi avaliada em nove ensaios com duração de 6 a 12 meses em adultos e em um ensaio com duração de 12 meses em pacientes pediátricos com 1 ano de idade ou mais com diabetes tipo 1. A segurança cardiovascular de TRESIBA foi avaliada num ensaio duplo-cego, orientado por eventos, com duração média de 2 anos, em pacientes com diabetes tipo 2 com alto risco de eventos cardiovasculares.
Os dados da Tabela 1 refletem a exposição de 1.102 adultos com diabetes tipo 1 ao TRESIBA com uma duração média de exposição ao TRESIBA de 34 semanas em três ensaios abertos; Estudo A, B e C. A média de idade foi de 43 anos e 1% tinha mais de 75 anos. Cinquenta e sete por cento eram do sexo masculino, 81% eram brancos, 2% eram negros ou afro-americanos e 4% eram hispânicos. O índice de massa corporal (IMC) médio foi de 26 kg/m2. A duração média do diabetes foi de 18 anos e a HbA média1c no início do estudo foi de 7,8%. Uma história de neuropatia, oftalmopatia, nefropatia e doença cardiovascular no início do estudo foi relatada em 11%, 16%, 7% e 0,5%, respectivamente. A TFGe média no início do estudo foi de 87 mL/min/1,73 m2 e 7% dos pacientes tinham TFGe inferior a 60 mL/min/1,73 m2.
Os dados da Tabela 2 refletem a exposição de 2.713 adultos com diabetes tipo 2 ao TRESIBA com uma duração média de exposição ao TRESIBA de 36 semanas em seis ensaios abertos; Estudo D, E, F, G, H e I. A média de idade foi de 58 anos e 3% tinham mais de 75 anos. Cinquenta e oito por cento eram do sexo masculino, 71% eram brancos, 7% eram negros ou afro-americanos e 13% eram hispânicos. O IMC médio foi de 30 kg/m2. A duração média do diabetes foi de 11 anos e a HbA média1c no início do estudo foi de 8,3%. Uma história de neuropatia, oftalmopatia, nefropatia e doença cardiovascular no início do estudo foi relatada por 14%, 10%, 6% e 0,6% dos participantes, respectivamente. No início do estudo, a TFGe média foi de 83 mL/min/1,73 m2 e 9% tinham TFGe inferior a 60 mL/min/1,73 m2.
As reações adversas comuns (excluindo hipoglicemia) que ocorrem em indivíduos tratados com TRESIBA durante ensaios clínicos em pacientes adultos com diabetes mellitus tipo 1 e adultos com diabetes mellitus tipo 2 estão listadas na Tabela 1 e na Tabela 2, respectivamente. As reações adversas comuns foram definidas como reações que ocorrem em ≥5% da população estudada. A hipoglicemia não é mostrada nessas tabelas, mas é discutida em uma subseção dedicada abaixo.
174 pacientes pediátricos com 1 ano de idade ou mais com diabetes tipo 1 foram expostos ao TRESIBA com uma exposição média ao TRESIBA de 48 semanas. A idade média foi de 10 anos: 25% tinham entre 1 e 5 anos, 40% tinham entre 6 e 11 anos e 35% tinham entre 12 e 17 anos. 55% eram homens, 78% eram brancos, 3% eram negros ou afro-americanos e 4% eram hispânicos. O índice de massa corporal (IMC) médio foi de 18,7 kg/m2. A duração média do diabetes foi de 3,9 anos e a HbA média1c no início do estudo foi de 8,2%. As reações adversas comuns em pacientes pediátricos tratados com TRESIBA com diabetes mellitus tipo 1 foram semelhantes às reações adversas listadas na Tabela 1.
Tabela 1: Reações adversas que ocorrem em ≥5% dos pacientes adultos tratados com TRESIBA com diabetes mellitus tipo 1
| Reação adversa | TRESIBA
(N=1.102) |
| Nasofaringite | 23,9% |
| Infecção do trato respiratório superior | 11,9% |
| Dor de cabeça | 11,8% |
| Sinusite | 5,1% |
| Gastroenterite | 5,1% |
Tabela 2: Reações adversas que ocorrem em ≥5% dos pacientes adultos tratados com TRESIBA com diabetes mellitus tipo 2
| Reação adversa | TRESIBA
(N=2.713) |
| Nasofaringite | 12,9% |
| Dor de cabeça | 8,8% |
| Infecção do trato respiratório superior | 8,4% |
| Diarréia | 6,3% |
Hipoglicemia
A hipoglicemia foi a reação adversa mais comumente observada em pacientes tratados com TRESIBA. As taxas de hipoglicemia relatadas dependem da definição de hipoglicemia utilizada, tipo de diabetes, dose de insulina, intensidade do controle da glicose, terapias de base e outros fatores intrínsecos e extrínsecos do paciente. Por estas razões, comparar as taxas de hipoglicemia em ensaios clínicos para TRESIBA com a incidência de hipoglicemia para outros produtos pode ser enganosa e também pode não ser representativa das taxas de hipoglicemia que ocorrerão na prática clínica.
Nos ensaios clínicos abertos em adultos de pacientes com diabetes tipo 1 e tipo 2, e no ensaio clínico pediátrico aberto de pacientes com diabetes tipo 1, porcentagens de pacientes adultos e pediátricos com diabetes tipo 1 randomizados para TRESIBA que tiveram pelo menos pelo menos um episódio de hipoglicemia em ensaios clínicos e adultos com diabetes tipo 2 são mostrados nas Tabelas 3 e 4, respectivamente.
A hipoglicemia grave nos ensaios abertos com pacientes adultos foi definida como um episódio que requer assistência de outra pessoa para administrar ativamente carboidratos, glucagon ou outras ações de ressuscitação. A hipoglicemia grave no ensaio pediátrico foi definida como um estado mental alterado em que a criança não conseguia ajudar nos seus próprios cuidados, estava semiconsciente ou inconsciente, ou em coma ± convulsões e pode necessitar de terapia parentérica (glucagon ou glicose intravenosa). Um episódio de hipoglicemia foi definido como um episódio de hipoglicemia grave ou um episódio em que a glicose laboratorial ou automedida calibrada para plasma era inferior a 56 mg/dL ou em que a glicemia total era inferior a 50 mg/dL (isto é, com ou sem a presença de sintomas hipoglicêmicos).
Tabela 3: Porcentagem (%) de pacientes com diabetes tipo 1 que apresentam pelo menos um episódio de hipoglicemia grave ou hipoglicemia§ no TRESIBA em ensaios clínicos abertos em adultos e pediátricos
| Estudo A Adultos + insulina aspártico 52 semanas |
Estudo B Adultos + insulina aspártico 26 semanas |
Estudo C Adultos + insulina aspártico 26 semanas |
Estudo J Pediatria + insulina aspártico 52 semanas |
||
|---|---|---|---|---|---|
| TRESIBA (N=472) |
TRESIBA (N=301) |
TRESIBA no mesmo horário todos os dias (N=165) |
TRESIBA em horários alternados (N=164) |
TRESIBA (N=174) |
|
| Hipoglicemia grave* | |||||
| Porcentagem de pacientes | 12,3% | 10,6% | 12,7% | 10,4% | 17,8% |
| Hipoglicemia§ | |||||
| Porcentagem de pacientes | 95,6% | 93,0% | 99,4% | 93,9% | 98,3% |
*Hipoglicemia grave em pacientes pediátricos: episódio com alteração do estado mental, em que a criança não pôde auxiliar nos seus próprios cuidados, ficou semiconsciente ou inconsciente, ou em coma ± convulsões, podendo necessitar de terapia parenteral (glucagon ou glicose intravenosa).
§Hipoglicemia: um episódio grave de hipoglicemia ou um episódio em que a glicose laboratorial ou automedida calibrada no plasma foi inferior a 56 mg/dL ou em que a glicemia total foi inferior a 50 mg/dL (ou seja, com ou sem a presença de sintomas hipoglicêmicos ).
Tabela 4: Porcentagem (%) de pacientes com diabetes tipo 2 que apresentam pelo menos um episódio de hipoglicemia grave ou hipoglicemia§ sobre TRESIBA em ensaios clínicos abertos em adultos
| Estudo D + 1-2 ADOs* ingênuo de insulina 52 semanas |
Estudo E + 1-2 ADOs* ingênuo de insulina 26 semanas |
Estudo F ± 1-3 ADOs* ingênuo à insulina 26 semanas |
Estudo G DM2 ± 0-3 ADOs* 26 semanas |
Estudo H DM2 ± 0-2 ADOs* + insulina aspártico 52 semanas |
Estudo eu DM2 ± 1-2 ADOs* ingênuo à insulina 26 semanas |
||
|---|---|---|---|---|---|---|---|
| TRESIBA (N=766) |
TRESIBA (N=228) |
TRESIBA (N=284) |
TRESIBA (N=226) |
TRESIBA (alternando tempo) (N=230) |
TRESIBA (N=753) |
TRESIBA (N=226) |
|
| Hipoglicemia grave | |||||||
| Porcentagem de pacientes | 0,3% | 0,9% | 0,4% | 4,5% | 0,4% | ||
| Hipoglicemia§ | |||||||
| Porcentagem de pacientes | 46,5% | 28,5% | 50% | 43,8% | 50,9% | 80,9% | 42,5% |
*AOAD: agente antidiabético oral, §Hipoglicemia: um episódio grave de hipoglicemia ou um episódio em que a glicose laboratorial ou automedida calibrada no plasma foi inferior a 56 mg/dL ou em que a glicemia total foi inferior a 50 mg/dL (ou seja, com ou sem a presença de sintomas hipoglicêmicos ).
Reações de hipersensibilidade
Alergia generalizada grave, com risco de vida, incluindo anafilaxia, reações cutâneas generalizadas, angioedema, broncoespasmo, hipotensão e choque ocorreram com insulina, incluindo TRESIBA e podem ser fatais. Hipersensibilidade (manifestada com inchaço da língua e lábios, diarréia, náusea, cansaço e coceira) e urticária foram relatadas em 0,9% dos pacientes tratados com TRESIBA.
Lipodistrofia
O uso prolongado de insulina, incluindo TRESIBA, pode causar lipodistrofia no local de injeções repetidas de insulina. A lipodistrofia inclui lipohipertrofia (espessamento do tecido adiposo) e lipoatrofia (afinamento do tecido adiposo) e pode afetar a absorção de insulina. No programa clínico, foi relatada lipodistrofia, lipohipertrofia ou lipoatrofia em 0,3% dos pacientes tratados com TRESIBA.
Reações no local da injeção
Os pacientes que tomam TRESIBA podem apresentar reações no local da injeção, incluindo hematoma no local da injeção, dor, hemorragia, eritema, nódulos, inchaço, descoloração, prurido, calor e massa no local da injeção. No programa clínico, ocorreram reações no local da injeção em 3,8% dos pacientes tratados com TRESIBA.
Ganho de peso
O ganho de peso pode ocorrer com a terapia com insulina, incluindo TRESIBA, e tem sido atribuído aos efeitos anabólicos da insulina. No programa clínico, após 52 semanas de tratamento, os pacientes com diabetes tipo 1 tratados com TRESIBA ganharam em média 1,8 kg e os pacientes com diabetes tipo 2 tratados com TRESIBA ganharam em média 3,0 kg.
Edema periférico
TRESIBA, pode causar retenção de sódio e edema. No programa clínico, ocorreu edema periférico em 0,9% dos pacientes com diabetes mellitus tipo 1 e 3,0% dos pacientes com diabetes mellitus tipo 2 tratados com TRESIBA.
6.2 Imunogenicidade
Tal como acontece com todas as proteínas terapêuticas, a administração de insulina pode causar a formação de anticorpos anti-insulina. A detecção da formação de anticorpos é altamente dependente da sensibilidade e especificidade do ensaio e pode ser influenciada por vários factores, tais como: metodologia do ensaio, manuseamento da amostra, momento da colheita da amostra, medicação concomitante e doença subjacente. Por estas razões, a comparação da incidência de anticorpos contra TRESIBA com a incidência de anticorpos noutros estudos ou com outros produtos pode ser enganosa.
Em um estudo de 52 semanas com pacientes adultos com diabetes tipo 1 com experiência em insulina, 68,9% dos pacientes que receberam TRESIBA foram positivos no início do estudo para anticorpos anti-insulina degludec e 12,3% dos pacientes desenvolveram anticorpos anti-insulina degludec pelo menos uma vez durante o julgamento. Em um ensaio de 52 semanas com pacientes pediátricos com diabetes tipo 1 com experiência em insulina, 84,1% dos pacientes que receberam TRESIBA foram positivos no início do estudo para anticorpos anti-insulina degludec e 5,8% dos pacientes desenvolveram anticorpos anti-insulina degludec pelo menos uma vez durante o ensaio. . Num ensaio de 52 semanas com pacientes adultos com diabetes tipo 2 sem insulina prévia, 1,7% dos pacientes que receberam TRESIBA w Foram positivos no início do estudo para anticorpos anti-insulina degludec e 6,2% dos pacientes desenvolveram anticorpos anti-insulina degludec pelo menos uma vez durante o ensaio. Nestes ensaios, entre 96,7% e 99,7% dos doentes que foram positivos para anticorpos anti-insulina degludec também foram positivos para anticorpos anti-insulina humana.
6.3 Experiência pós-comercialização
As seguintes reações adversas adicionais foram identificadas durante o uso pós-aprovação de TRESIBA. Como estas reações são notificadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança a sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Ocorreu amiloidose cutânea localizada no local da injeção. Foi relatada hiperglicemia com injeções repetidas de insulina em áreas de amiloidose cutânea localizada; hipoglicemia foi relatada com uma mudança repentina para um local de injeção não afetado.
7. Interações medicamentosas
A Tabela 5 inclui interações medicamentosas clinicamente significativas com TRESIBA.
Tabela 5: Interações medicamentosas clinicamente significativas com TRESIBA
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8. Uso em populações específicas
8.1 Gravidez
Resumo de riscos
Os dados disponíveis de um ensaio não publicado e a literatura publicada com o uso de TRESIBA durante a gravidez não identificaram um risco associado ao medicamento de defeitos congênitos graves, aborto espontâneo ou outros resultados maternos ou fetais adversos. Num ensaio clínico randomizado, de grupos paralelos, aberto, ativamente controlado, que incluiu 91 mulheres grávidas com diabetes tipo 1 que receberam TRESIBA uma vez ao dia e insulina aspártico, começando nas semanas 8 a 13 de gestação ou antes da concepção, não houve evidência clara de foi observado risco materno ou fetal associado ao uso de TRESIBA. Existem riscos para a mãe e para o feto associados ao diabetes mal controlado durante a gravidez.
Ratos e coelhos foram expostos à insulina degludec em estudos de reprodução animal durante a organogênese. Perdas pré e pós-implantação e anormalidades viscerais/esqueléticas foram observadas em ratos em doses 5 vezes (rato) e 10 vezes (coelho) a exposição humana na dose de 0,75 U/kg/dia. Esses efeitos foram semelhantes aos observados em ratos aos quais foi administrada insulina humana (NPH).
Na população geral dos EUA, o risco estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente. O risco de base estimado de defeitos congênitos graves é de 6 a 10% em mulheres com diabetes pré-gestacional com HbA1c peri-concepcional1c >7 e foi relatado que chega a 20 a 25% em mulheres com HbA1c peri-concepcional1c >10. O risco de base estimado de aborto espontâneo para a população indicada é desconhecido.
Considerações Clínicas
Risco materno e/ou embrionário/fetal associado a doenças
Hipoglicemia e hiperglicemia ocorrem com mais frequência durante a gravidez em pacientes com diabetes pré-gestacional. O diabetes mal controlado na gravidez aumenta o risco materno de cetoacidose diabética, pré-eclâmpsia, abortos espontâneos, parto prematuro e complicações no parto. O diabetes mal controlado aumenta o risco fetal de defeitos congênitos graves, natimortos e morbidade relacionada à macrossomia.
Dados
Dados Humanos
Num ensaio clínico aberto, 185 mulheres grávidas com diabetes tipo 1 foram tratadas com TRESIBA (uma vez por dia) ou insulina detemir (uma ou duas vezes por dia); ambos os grupos receberam insulina aspártico 2 a 4 vezes ao dia com as refeições. Não houve diferenças significativas associadas aos medicamentos nos resultados da gravidez ou na saúde do feto e do recém-nascido entre os dois grupos. Neste estudo, a proporção de indivíduos com hipoglicemia grave e hipoglicemia foi semelhante entre os dois braços de tratamento; para as definições de hipoglicemia grave e hipoglicemia. O mau controle glicêmico durante a gravidez em ambos os grupos e o pequeno tamanho da amostra foram limitações do estudo.
Em cerca de dois terços dos lactentes, a insulina degludec foi detectada no sangue do cordão umbilical infantil em níveis acima do nível inferior de quantificação do ensaio.
Dados de animais
A insulina degludec foi investigada em estudos que abrangeram fertilidade, desenvolvimento embriofetal e desenvolvimento pré e pós-natal em ratos e durante o período de desenvolvimento embriofetal em coelhos. A insulina humana (insulina NPH) foi incluída como comparador. Nestes estudos, a insulina degludec causou perdas pré e pós-implantação e anomalias viscerais/esqueléticas quando administrada por via subcutânea até 21 U/kg/dia em ratos e 3,3 U/kg/dia em coelhos, resultando em 5 vezes (rato) e 10 vezes (coelho) a exposição humana (AUC) numa dose subcutânea humana de 0,75 U/kg/dia. Globalmente, os efeitos da insulina degludec foram semelhantes aos observados com a insulina humana, provavelmente secundários à hipoglicemia materna.
8.2 Lactação
Resumo de riscos
Não existem dados sobre a presença de insulina degludec no leite humano, os efeitos no lactente ou na produção de leite. A insulina degludec está presente no leite de rato (veja Dados). Os benefícios da amamentação para o desenvolvimento e a saúde devem ser considerados juntamente com a necessidade clínica da mãe de TRESIBA e quaisquer efeitos adversos potenciais de TRESIBA para o bebê amamentado ou da condição materna subjacente.
Dados
Em ratos lactantes, a insulina degludec estava presente no leite numa concentração inferior à do plasma.
8.4 Uso Pediátrico
A segurança e eficácia de TRESIBA para melhorar o controle glicêmico em pacientes pediátricos com 1 ano de idade ou mais com diabetes mellitus foram estabelecidas. O uso de TRESIBA para esta indicação é apoiado por evidências de um ensaio adequado e bem controlado e de um estudo farmacocinético (os ensaios incluíram pacientes pediátricos com 1 ano de idade ou mais com diabetes mellitus tipo 1). O uso de TRESIBA em pacientes pediátricos com 1 ano de idade ou mais com diabetes mellitus tipo 2 também é apoiado por evidências de ensaios adequados e bem controlados em adultos com diabetes mellitus tipo 2.
Em pacientes pediátricos com 1 ano de idade ou mais que já estejam em terapia com insulina, iniciar TRESIBA em dose reduzida para minimizar o risco de hipoglicemia.
A segurança e eficácia de TRESIBA não foram estabelecidas em pacientes pediátricos com menos de 1 ano de idade.
8.5 Uso Geriátrico
Em ensaios clínicos controlados um total de 77 (7%) dos 1.102 pacientes tratados com TRESIBA com diabetes tipo 1 tinham 65 anos ou mais e 9 (1%) tinham 75 anos ou mais. Um total de 670 (25%) dos 2.713 pacientes tratados com TRESIBA com diabetes tipo 2 tinham 65 anos ou mais e 80 (3%) tinham 75 anos ou mais. Não foram sugeridas diferenças na segurança ou eficácia nas análises de subgrupos comparando indivíduos com mais de 65 anos com indivíduos mais jovens.
No ensaio de resultados de segurança (DEVOTE), um total de 1.983 (52%) dos 3.818 pacientes tratados com TRESIBA com diabetes tipo 2 tinham 65 anos ou mais e 381 (10%) tinham 75 anos ou mais. Não foram observadas diferenças na segurança ou eficácia nestas análises de subgrupos.
No entanto, deve-se ter maior cautela quando TRESIBA é administrado a pacientes geriátricos, uma vez que não pode ser descartada uma maior sensibilidade de alguns indivíduos mais velhos aos efeitos de TRESIBA. A dosagem inicial, os incrementos de dose e a dosagem de manutenção devem ser conservadores para evitar hipoglicemia. A hipoglicemia pode ser mais difícil de reconhecer nos pacientes geriátricos.
8.6 Insuficiência Renal
Em ensaios clínicos um total de 75 (7%) dos 1.102 pacientes tratados com TRESIBA com diabetes tipo 1 tiveram uma TFGe inferior a 60 mL/min/1,73 m22 e 1 (0,1%) tinha TFGe inferior a 30 mL/min/1,73 m2. Um total de 250 (9%) dos 2.713 pacientes tratados com TRESIBA com diabetes tipo 2 tiveram uma TFGe inferior a 60 mL/min/1,73 m2 e nenhum indivíduo apresentou TFGe inferior a 30 mL/min/1,73 m2.
No estudo de resultados de segurança (DEVOTE), um total de 1.429 (37,4%) dos 3.818 pacientes tratados com TRESIBA com diabetes tipo 2 tiveram uma TFGe inferior a 60 mL/min/1,73 m2e 108 (2,8%) indivíduos tiveram uma TFGe inferior a 30 mL/min/1,73 m2. Não foram observadas diferenças na segurança ou eficácia nas análises de subgrupos.
Nenhuma diferença clinicamente relevante na farmacocinética de TRESIBA foi identificada em um estudo comparando indivíduos saudáveis e indivíduos com insuficiência renal, incluindo indivíduos com doença renal em estágio terminal. Contudo, tal como acontece com todas as insulinas, a monitorização da glicose deve ser intensificada e a posologia de TRESIBA ajustada individualmente em doentes com insuficiência renal.
8.7 Insuficiência Hepática
Nenhuma diferença na farmacocinética de TRESIBA foi identificada em um estudo comparando indivíduos saudáveis e indivíduos com insuficiência hepática (insuficiência hepática leve, moderada e grave). Contudo, tal como acontece com todas as insulinas, a monitorização da glicose deve ser intensificada e a posologia de TRESIBA ajustada individualmente em doentes com compromisso hepático.
10. Sobredosagem
Um excesso de insulina em relação à ingestão de alimentos, ao gasto energético ou a ambos pode levar a hipoglicemia e hipocalemia graves e, às vezes, prolongadas e potencialmente fatais. Episódios leves de hipoglicemia geralmente podem ser tratados com glicose oral. Pode ser necessário reduzir a dosagem de insulina e ajustar os padrões de alimentação ou exercícios. Episódios mais graves de hipoglicemia com coma, convulsão ou comprometimento neurológico podem ser tratados com glucagon para uso emergencial ou glicose intravenosa concentrada. Após aparente recuperação clínica da hipoglicemia, pode ser necessária observação contínua e ingestão adicional de carboidratos para evitar a recorrência da hipoglicemia. A hipocalemia deve ser corrigida adequadamente.
11. Descrição de Tresiba
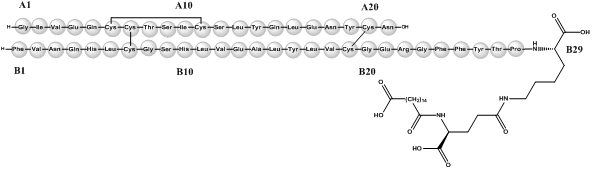
A insulina degludec é um análogo da insulina humana basal de ação prolongada para injeção subcutânea, produzido por um processo que inclui a expressão de DNA recombinante em Saccharomyces cerevisiae seguido de modificação química.
A insulina degludec difere da insulina humana porque o aminoácido treonina na posição B30 ha s foi omitido e uma cadeia lateral consistindo de ácido glutâmico e um ácido graxo C16 foi anexada (nome químico: LysB29 (Nε-hexadecandioil-γ-Glu) des (B30) insulina humana). A insulina degludec tem uma fórmula molecular de C274H411N65Ó81S6 e um peso molecular de 6,104 kDa. Possui a seguinte estrutura:
Figura 1: Fórmula Estrutural da Insulina Degludec
A injeção de TRESIBA (insulina degludec) é uma solução estéril, aquosa, límpida e incolor disponível em 100 unidades/mL (U-100) ou 200 unidades/mL (U-200) para uso subcutâneo.
Para a solução de 100 unidades/mL, cada mL contém 100 unidades de insulina degludec e glicerina (19,6 mg), metacresol (1,72 mg), fenol (1,5 mg), zinco (32,7 mcg) e Água para Injetáveis, USP.
Para a solução de 200 unidades/mL, cada mL contém 200 unidades de insulina degludec e glicerina (19,6 mg), metacresol (1,72 mg), fenol (1,5 mg), zinco (71,9 mcg) e Água para Injetáveis, USP.
TRESIBA tem um pH de aproximadamente 7,6. Ácido clorídrico ou hidróxido de sódio podem ser adicionados para ajustar o pH.
12. Tresiba – Farmacologia Clínica
12.1 Mecanismo de Ação
A atividade primária da insulina, incluindo TRESIBA, é a regulação do metabolismo da glicose. A insulina e seus análogos reduzem a glicemia, estimulando a captação periférica de glicose, especialmente pelo músculo esquelético e pela gordura, e inibindo a produção hepática de glicose. A insulina também inibe a lipólise e a proteólise e aumenta a síntese protéica. TRESIBA forma multi-hexâmeros quando injetado no tecido subcutâneo, resultando em um depósito subcutâneo de insulina degludec. O perfil de ação de tempo prolongado de TRESIBA deve-se predominantemente à absorção retardada da insulina degludec do tecido subcutâneo para a circulação sistêmica e, em menor extensão, devido à ligação da insulina degludec à albumina circulante.
12.2 Farmacodinâmica
O efeito de redução da glicose de TRESIBA após 8 dias de administração uma vez ao dia foi medido em um estudo de controle de glicose euglicêmico que envolveu 21 pacientes com diabetes tipo 1. A Figura 2 mostra o efeito farmacodinâmico de TRESIBA ao longo do tempo após 8 injeções subcutâneas uma vez ao dia de 0,4 U/kg de TRESIBA em pacientes com diabetes tipo 1.
Figura 2: Perfil GIR médio para dose de 0,4 unidades/kg de TRESIBA (estado estacionário) em pacientes com diabetes mellitus tipo 1
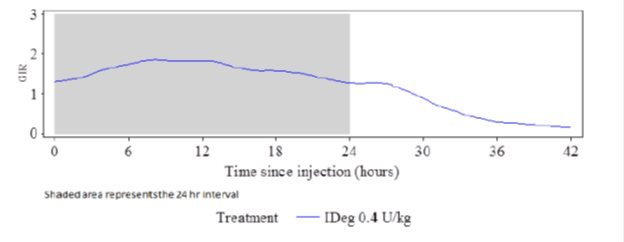
O efeito máximo médio de redução da glicose (GIRmáx.) de uma dose de 0,4 unidades/kg de TRESIBA foi de 2,0 mg/kg/min, o que foi observado em uma mediana de 12 horas após a dose. O efeito de redução da glicose de TRESIBA durou pelo menos 42 horas após a última das 8 injeções diárias.
Em pacientes com diabetes mellitus tipo 1, o estado estacionário, dentro dos indivíduos, a variabilidade diária no efeito total de redução da glicose foi de 20% com TRESIBA (coeficiente de variação dentro do indivíduo para AUCGIR,τ,SS).
O efeito total de redução da glicose de TRESIBA ao longo de 24 horas, medido em um estudo de clamp euglicêmico após 8 dias de administração uma vez ao dia em pacientes com diabetes tipo 1, aumenta aproximadamente em proporção à dose para doses entre 0,4 unidades/kg a 0,8 unidades/kg .
O efeito total de redução da glicose de 0,4 unidades/kg de TRESIBA U-100 e 0,4 unidades/kg de TRESIBA U-200, administrados na mesma dose e avaliados durante 24 horas em um estudo de clamp euglicêmico após 8 dias de administração uma vez ao dia injeção foi comparável.
12.3 Farmacocinética
Absorção
Em pacientes com diabetes tipo 1, após 8 dias de administração subcutânea única diária de 0,4 unidades/kg de TRESIBA, concentrações máximas de insulina degludec de 4.472 pmol/L foram atingidas em uma mediana de 9 horas (tmáx.). Após a primeira dose de TRESIBA, o início médio do aparecimento foi de cerca de uma hora.
A concentração total de insulina degludec (ou seja, exposição) aumentou de forma proporcional à dose após administração subcutânea de 0,4 unidades/kg a 0,8 unidades/kg de TRESIBA. A exposição total e máxima à insulina degludec no estado estacionário é comparável entre TRESIBA U-100 e TRESIBA U-200 quando cada um é administrado na mesma dose de unidades/kg.
A concentração de insulina degludec atingiu níveis de estado estacionário após 3-4 dias da administração de TRESIBA.
Distribuição
A afinidade da insulina degludec com a albumina sérica corresponde a uma ligação às proteínas plasmáticas >99% no plasma humano. Os resultados do em vitro estudos de ligação às proteínas demonstram que não existe interação clinicamente relevante entre a insulina degludec e outros medicamentos ligados às proteínas.
Eliminação
A meia-vida após administração subcutânea é determinada principalmente pela taxa de absorção do tecido subcutâneo. Em média, a meia-vida no estado estacionário é de aproximadamente 25 horas, independente da dose. A degradação do TRESIBA é semelhante à da insulina humana; todos os metabólitos formados são inativos. A depuração aparente média da insulina degludec é de 0,03 L/kg (2,1 L/h em pacientes de 70 kg) após dose subcutânea única de 0,4 unidades/kg.
Populações Específicas
Pediatria-
A análise farmacocinética populacional foi realizada para TRESIBA utilizando dados de 199 indivíduos pediátricos (1 a <18 anos de idade) com diabetes tipo 1. O peso corporal foi uma covariável significativa que afetou a depuração de TRESIBA. Após ajuste para o peso corporal, a exposição total de TRESIBA no estado estacionário foi independente da idade.
Geriatria-
A resposta farmacocinética e farmacodinâmica de TRESIBA foi comparada em 13 adultos jovens (18-35 anos) e 14 indivíduos geriátricos (≥65 anos) com diabetes tipo 1 após dois períodos de 6 dias de administração subcutânea uma vez ao dia com dose de 0,4 unidades/kg de TRESIBA ou insulina glargina. Em média, as propriedades farmacocinéticas e farmacodinâmicas de TRESIBA no estado estacionário foram semelhantes em adultos jovens e indivíduos geriátricos, embora com maior variabilidade entre indivíduos entre os indivíduos geriátricos.
Gênero-
O efeito do gênero na farmacocinética de TRESIBA foi examinado em uma análise transversal dos estudos farmacocinéticos e farmacodinâmicos realizados utilizando doses unitárias/kg de TRESIBA. Globalmente, não houve diferenças clinicamente relevantes nas propriedades farmacocinéticas da insulina degludec entre indivíduos do sexo feminino e masculino.
Obesidade-
O efeito do IMC na farmacocinética de TRESIBA foi explorado em uma análise cruzada de estudos farmacocinéticos e farmacodinâmicos realizados utilizando doses unitárias/kg de TRESIBA. Para indivíduos com diabetes tipo 1, não foi observada relação entre a exposição de TRESIBA e o IMC. Para indivíduos com diabetes tipo 1 e tipo 2, foi observada uma tendência de diminuição do efeito redutor da glicose de TRESIBA com o aumento do IMC.
Raça e etnia-
TRESIBA foi estudado num estudo farmacocinético e farmacodinâmico em indivíduos negros ou afro-americanos não de origem hispânica ou latina (N = 18), indivíduos brancos de origem hispânica ou latina (N = 22) e indivíduos brancos não de origem hispânica ou latina ( N=23) com diabetes mellitus tipo 2 realizado com doses unitárias/kg de TRESIBA. Não houve diferenças estatisticamente significativas nas propriedades farmacocinéticas e farmacodinâmicas de TRESIBA entre os grupos raciais e étnicos investigados.
Gravidez-
O efeito da gravidez na farmacocinética e farmacodinâmica de TRESIBA não foi estudado.
Insuficiência renal-
A farmacocinética de TRESIBA foi estudada em 32 indivíduos (N=4-8/grupo) com função renal normal ou comprometida/doença renal em estágio terminal após administração de uma dose subcutânea única (0,4 unidades/kg) de TRESIBA. A função renal foi definida usando a depuração de creatinina (Clcr) da seguinte forma: ≥90 mL/min (normal), 60-89 mL/min (leve), 30-59 mL/min (moderada) e <30 mL/min (grave) . Os indivíduos que necessitaram de diálise foram classificados como portadores de doença renal em estágio terminal (DRT). Total (AUCIDeg,0-120h,SD) e a exposição máxima de TRESIBA foram, em média, cerca de 10-25% e 13-27% mais elevadas, respetivamente, em indivíduos com compromisso renal ligeiro a grave, exceto indivíduos com doença renal terminal que apresentaram exposição semelhante em comparação com indivíduos com função renal normal. Nenhuma tendência sistemática foi observada para este aumento na exposição em diferentes subgrupos de insuficiência renal. A hemodiálise não afetou a depuração de TRESIBA (CL/FIDeg,SD) em indivíduos com DRT.
Insuficiência Hepática-
TRESIBA foi estudado num estudo farmacocinético em 24 indivíduos (N=6/grupo) com função hepática normal ou comprometida (insuficiência hepática ligeira, moderada e grave) após administração de uma dose subcutânea única (0,4 unidades/kg) de TRESIBA. A função hepática foi definida utilizando pontuações de Child-Pugh variando de 5 (insuficiência hepática leve) a 15 (insuficiência hepática grave). Não foram identificadas diferenças na farmacocinética de TRESIBA entre indivíduos saudáveis e indivíduos com insuficiência hepática.
13. Toxicologia Não Clínica
13.1 Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Não foram realizados estudos padrão de carcinogenicidade em animais com duração de 2 anos para avaliar o potencial carcinogênico da insulina degludec. Em um estudo de 52 semanas incluindo insulina humana (insulina NPH) como comparador (6,7 unidades/kg/dia), ratos Sprague-Dawley receberam doses subcutâneas de insulina degludec a 3,3, 6,7 e 10 unidades/kg/dia, resultando em 5 vezes a exposição humana (AUC) quando comparada com uma dosagem subcutânea humana de 0,75 unidades/kg/dia. A insulina humana foi dosada em 6,7 unidades/kg/dia. Não foram registados aumentos relacionados com o tratamento na incidência de hiperplasia, tumores benignos ou malignos nas glândulas mamárias femininas de ratos aos quais foi administrada insulina degludec e não foram encontradas alterações relacionadas com o tratamento na proliferação de células da glândula mamária feminina utilizando a incorporação de BrdU. Além disso, não foram observadas alterações relacionadas com o tratamento na ocorrência de lesões hiperplásicas ou neoplásicas noutros tecidos em animais aos quais foi administrada insulina degludec quando comparada com veículo ou insulina humana.
Não foram realizados testes de genotoxicidade da insulina degludec.
Num estudo combinado de fertilidade e embriofetal em ratos machos e fêmeas, o tratamento com insulina degludec até 21 unidades/kg/dia (aproximadamente 5 vezes a dose subcutânea humana de 0,75 unidades/kg/dia, com base em unidades/área de superfície corporal ) antes do acasalamento e em ratas durante a gestação não teve efeito no desempenho do acasalamento e na fertilidade.
14. Estudos Clínicos
A eficácia de TRESIBA administrado uma vez ao dia, no mesmo horário todos os dias ou a qualquer hora todos os dias, em pacientes com diabetes tipo 1 e usado em combinação com uma insulina às refeições, foi avaliada em três estudos randomizados, abertos e tratados de acordo com o alvo. , ensaios controlados com ativos em adultos e um ensaio randomizado, aberto, tratamento para o alvo e controlado com ativos em pacientes pediátricos com 1 ano de idade ou mais. A eficácia de TRESIBA administrado uma vez ao dia, à mesma hora todos os dias ou a qualquer hora todos os dias, em pacientes adultos com diabetes tipo 2 e usado em combinação com uma insulina às refeições ou em combinação com agentes antidiabéticos orais comuns foi avaliada em seis ensaios clínicos randomizados, abertos, de tratamento para o alvo, controlados por ativos.
Pacientes adultos tratados com TRESIBA alcançaram níveis de controle glicêmico semelhantes aos alcançados com LANTUS (insulina glargina 100 unidades/mL) e LEVEMIR (insulina detemir) e alcançaram melhorias estatisticamente significativas em comparação com a sitagliptina.
14.1 Diabetes Tipo 1 – Adulto
TRESIBA administrado no mesmo horário todos os dias em combinação com um análogo de insulina de ação rápida na hora das refeições em pacientes adultos
Estudo A
A eficácia de TRESIBA foi avaliada em um ensaio multicêntrico, randomizado e aberto de 52 semanas em 629 pacientes com diabetes mellitus tipo 1 (Estudo A). Os pacientes foram randomizados para receber TRESIBA uma vez ao dia com o jantar ou insulina glargina U-100 uma vez ao dia de acordo com a bula aprovada. A insulina aspártico foi administrada antes de cada refeição em ambos os braços de tratamento.
A idade média da população experimental foi de 43 anos e a duração média do diabetes foi de 19 anos. 59% eram do sexo masculino. 93% eram brancos, 2% negros ou afro-americanos. 5% eram hispânicos. 9% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 26,3 kg/m2.
Na semana 52, a diferença na HbA1c a redução da linha de base entre TRESIBA e insulina glargina U-100 foi de -0,01% com um intervalo de confiança de 95% de [-0.14%; 0.11%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Ver Tabela 6, Estudo A.
Estudo B
A eficácia de TRESIBA foi avaliada em um ensaio multicêntrico, randomizado e aberto de 26 semanas em 455 pacientes com diabetes mellitus tipo 1 (Estudo B). Os pacientes foram randomizados para receber TRESIBA ou insulina detemir uma vez ao dia à noite. Após 8 semanas, a insulina detemir pode ser administrada duas vezes ao dia. 67% usaram insulina detemir uma vez ao dia no final do ensaio. 33% usaram insulina detemir duas vezes ao dia no final do ensaio. A insulina aspártico foi administrada antes de cada refeição em ambos os braços de tratamento.
A idade média da população do estudo foi de 41 anos e a duração média do diabetes foi de 14 anos. 52% eram do sexo masculino. 45% eram brancos, 0,4% negros ou afro-americanos. 4% eram hispânicos. 4% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 23,9 kg/m2.
Na semana 26, a diferença na HbA1c a redução da linha de base entre TRESIBA e insulina detemir foi de -0,09% com um intervalo de confiança de 95% de [-0.23%; 0.05%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Ver Tabela 6, Estudo B.
Tabela 6: Resultados na Semana 52 em um Estudo Comparando TRESIBA com Insulina Glargina U-100 (Estudo A) e Semana 26 em um Estudo Comparando TRESIBA com Insulina Detemir (Estudo B) em Pacientes Adultos com Diabetes Mellitus Tipo 1 Recebendo Insulina Aspart nas Refeições
| Estudo A | Estudo B | |||
| TRESIBA + Insulina aspártico | Insulina glargina U-100 + Insulina aspártico | TRESIBA + Insulina aspártico | Insulina detemir + Insulina aspártico | |
| N | 472 | 157 | 302 | 153 |
| HbA1c1c (%) | ||||
| Linha de base | 7.7 | 7.7 | 8,0 | 8,0 |
| Fim do julgamento | 7.3 | 7.3 | 7.3 | 7.3 |
| Alteração média ajustada em relação à linha de base* | -0,36 | -0,34 | -0,71 | -0,61 |
| Diferença estimada de tratamento [95%CI]
TRESIBA – insulina basal U-100 |
-0,01 [-0.14;0.11] | -0,09 [-0.23;0.05] | ||
| Proporção de obtenção de HbA1c1c <7% no final do teste | 39,8% | 42,7% | 41,1% | 37,3% |
| GPJ (mg/dL) | ||||
| Linha de base | 165 | 174 | 178 | 171 |
| Fim do julgamento | 141 | 149 | 131 | 161 |
| Alteração média ajustada em relação à linha de base | -27,6 | -21,6 | -43,3 | -13,5 |
| Dose diária de insulina basal | ||||
| Média da linha de base | 28 você | 26 você | 22 você | 22 você |
| Dose média no final do estudo | 29 você1 | 31 você1 | 25 U2 | 29 você2 |
| Dose diária de insulina em bolus | ||||
| Média da linha de base | 29 você | 29 você | 28 você | 31 você |
| Dose média no final do estudo | 32 você1 | 35 U1 | 36 você2 | 41 você2 |
- 1Na semana 52
- 2Na semana 26
- *A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo A, havia 14,8% dos indivíduos nos braços TRESIBA e 11,5% Insulina glargina para os quais faltavam dados no momento da HbA1c1c medição.
- No Estudo B, havia 6,3% de indivíduos nos braços TRESIBA e 9,8% Insulina detemir para os quais faltavam dados no momento da HbA1c1c medição.
Estudo C: TRESIBA administrado no mesmo horário todos os dias ou a qualquer hora todos os dias em combinação com um análogo de insulina de ação rápida na hora das refeições em pacientes adultos
A eficácia de TRESIBA foi avaliada em um ensaio multicêntrico, randomizado e aberto de 26 semanas em 493 pacientes com diabetes mellitus tipo 1. Os pacientes foram randomizados para TRESIBA injetado uma vez ao dia, no mesmo horário todos os dias (com o jantar principal), para TRESIBA injetado uma vez ao dia a qualquer hora do dia ou para insulina glargina U-100 injetada uma vez ao dia de acordo com a bula aprovada. O braço TRESIBA a qualquer hora do dia foi projetado para simular um esquema de injeção no pior cenário, alternando intervalos de dosagem curtos e longos, uma vez ao dia (ou seja, intervalos alternados de 8 a 40 horas entre as doses). TRESIBA neste braço foi administrado de manhã na segunda, quarta e sexta-feira e à noite na terça, quinta, sábado e domingo. A insulina aspártico foi administrada antes de cada refeição em todos os braços de tratamento.
A idade média da população do estudo foi de 43,7 anos e a duração média do diabetes foi de 19 anos. 58% eram do sexo masculino. 98% eram brancos, 2% negros ou afro-americanos. 3% eram hispânicos. 7% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 26,7 kg/m2.
Na semana 26, a diferença na HbA1c A redução da linha de base entre TRESIBA administrado em horários alternados e insulina glargina U-100 foi de 0,17% com um intervalo de confiança de 95% de [0.04%; 0.30%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Consulte a Tabela 7.
Tabela 7: Resultados na semana 26 em um ensaio comparando TRESIBA administrado uma vez ao dia no mesmo horário e em horários alternados todos os dias com insulina glargina U-100 em pacientes adultos com diabetes mellitus tipo 1 que recebem insulina aspártico nas refeições
| TRESIBA à mesma hora todos os dias + Insulina aspártico | TRESIBA em horários alternados + Insulina aspártico | Insulina glargina U-100 + Insulina aspártico | |
| N | 165 | 164 | 164 |
| HbA1c1c (%) | |||
| Linha de base | 7.7 | 7.7 | 7.7 |
| Fim do julgamento | 7.3 | 7.3 | 7.1 |
| Alteração média ajustada em relação à linha de base* | -0,41 | -0,40 | -0,57 |
| Diferença estimada de tratamento [95%CI]
TRESIBA alternada – Insulina glargina U-100 |
0,17 [0.04;0.30] | ||
| Proporção de obtenção de HbA1c1c <7% no final do teste | 37,0% | 37,2% | 40,9% |
| GPJ (mg/dL) | |||
| Linha de base | 179 | 173 | 175 |
| Fim do julgamento | 133 | 149 | 151 |
| Alteração média ajustada em relação à linha de base | -41,8 | -24,7 | -23,9 |
| Dose diária de insulina basal | |||
| Média da linha de base | 28 você | 29 você | 29 você |
| Dose média no final do estudo | 32 você | 36 você | 35 U |
| Dose diária de insulina em bolus | |||
| Média da linha de base | 29 você | 33 você | 32 você |
| Dose média no final do estudo | 27 você | 30 U | 35 U |
*A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
No Estudo C, havia 15,8% e 15,9% de indivíduos nos braços TRESIBA (mesmo horário e horários alternados, respectivamente) e 7,9% dos braços de insulina glargina para os quais faltavam dados no momento da HbA1c medição.
14.2 Diabetes Tipo 1 – Pacientes Pediátricos com 1 Ano de Idade ou Mais
Estudo J: TRESIBA administrado no mesmo horário todos os dias em combinação com um análogo de insulina de ação rápida na hora das refeições em pacientes pediátricos com 1 ano de idade ou mais
A eficácia de TRESIBA foi avaliada em um ensaio multicêntrico, randomizado, aberto e de 26 semanas em 350 pacientes com diabetes mellitus tipo 1 (Estudo J). Os pacientes foram randomizados para receber TRESIBA uma vez ao dia ou insulina detemir uma ou duas vezes ao dia. Os indivíduos em regime de insulina detemir duas vezes ao dia foram administrados no café da manhã e à noite, no jantar principal ou ao deitar. A insulina aspártico foi administrada antes de cada refeição principal em ambos os braços de tratamento. No final do ensaio, 36% usaram insulina detemir uma vez ao dia e 64% usaram insulina detemir duas vezes ao dia.
A idade média da população experimental foi de 10 anos; 24% tinham entre 1 e 5 anos; 39% tinham idades entre 6 e 11 anos e 36% tinham idades entre 12 e 17 anos. A duração média do diabetes foi de 4 anos. 55% eram do sexo masculino. 75% eram brancos, 3% negros ou afro-americanos. 3% eram hispânicos. O escore z médio para peso corporal foi de 0,31.
Na semana 26, a diferença na HbA1c a redução da linha de base entre TRESIBA e insulina detemir foi de 0,15% com um intervalo de confiança de 95% de [-0.03%; 0.33%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Consulte a Tabela 8.
Tabela 8: Resultados na semana 26 em um ensaio comparando TRESIBA com insulina Detemir em pacientes pediátricos de 1 ano de idade ou mais com diabetes mellitus tipo 1 que recebem insulina aspártico nas refeições
| TRESIBA+ Insulina aspártico | Insulina detemir + Insulina aspártico | |
| N | 174 | 176 |
| HbA1c1c (%) | ||
| Linha de base | 8.2 | 8,0 |
| Fim de 26 semanas | 8,0 | 7.7 |
| Alteração média ajustada da linha de base após 26 semanas ± | -0,19 | -0,34 |
| Diferença estimada de tratamento [95%CI]
TRESIBA v. Insulina detemir |
0,15 [ -0.03; 0.33] | |
| GPJ (mg/dL) | ||
| Linha de base | 162 | 151 |
| Fim de 26 semanas | 150 | 160 |
| Alteração média ajustada da linha de base após 26 semanas | 52,0 | 59,6 |
| Dose diária de insulina basal | ||
| Média da linha de base | 15 U (0,37 U/kg) | 16 U (0,41 U/kg) |
| Dose média após 26 semanas | 16 U (0,37 U/kg) | 22 U (0,51 U/kg) |
| Dose diária de insulina em bolus | ||
| Média da linha de base | 20 U (0,50 U/kg) | 20 U (0,52 U/kg) |
| Dose média após 26 semanas | 23 U (0,56 U/kg) | 22 U (0,57 U/kg) |
- ±A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com dados faltantes imputados por imputação múltipla, transportando o valor basal e adicionando o termo de erro, com tratamento, região, sexo e faixa etária como fatores fixos, e HbA basal1c como covariável.
- No Estudo J, havia 2,9% dos indivíduos nos braços TRESIBA e 6,3% nos braços Insulina detemir para os quais faltavam dados na HbA1c de 26 semanas1c medição.
14.3 Diabetes Tipo 2 – Adulto
Estudo D: TRESIBA administrado no mesmo horário todos os dias como um complemento à metformina com ou sem um inibidor DPP-4 em pacientes adultos virgens de insulina
A eficácia de TRESIBA foi avaliada em um estudo randomizado, aberto e multicêntrico de 52 semanas que envolveu 1.030 pacientes virgens de insulina com diabetes mellitus tipo 2 inadequadamente controlados com um ou mais agentes antidiabéticos orais (OADs). Os pacientes foram randomizados para receber TRESIBA uma vez ao dia com o jantar ou insulina glargina U-100 uma vez ao dia de acordo com a bula aprovada. A metformina isolada (83%) ou em combinação com um inibidor DPP-4 (18%) foi utilizada como terapia de base em ambos os braços de tratamento.
A idade média da população experimental foi de 59 anos e a duração média do diabetes foi de 9 anos. 62% eram do sexo masculino. 88% eram brancos, 7% negros ou afro-americanos. 17% eram hispânicos. 10% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 31,1 kg/m2.
Na semana 52, a diferença na HbA1c redução n da linha de base entre TRESIBA e insulina glargina U-100 foi de 0,09% com um intervalo de confiança de 95% de [-0.04%; 0.22%] e atendeu à margem de não inferioridade pré-especificada (0,4%); Consulte a Tabela 9.
Tabela 9: Resultados na Semana 52 de um Estudo Comparando TRESIBA com Insulina Glargina U-100 em Pacientes Adultos com Diabetes Mellitus Tipo 2 em uso de OAD(s)*
| TRESIBA + OAD(s)* | Insulina glargina U-100 + OAD(s)* | ||
| N | 773 | 257 | |
| HbA1c1c (%) | |||
| Linha de base | 8.2 | 8.2 | |
| Fim do julgamento | 7.1 | 7,0 | |
| Alteração média ajustada em relação à linha de base** | -1,06 | -1,15 | |
| Diferença estimada de tratamento [95%CI]
TRESIBA – Insulina glargina U-100 |
0,09 [-0.04;0.22] | ||
| Proporção de obtenção de HbA1c1c <7% no final do teste | 51,7% | 54,1% | |
| GPJ (mg/dL) | |||
| Linha de base | 174 | 174 | |
| Fim do julgamento | 106 | 115 | |
| Alteração média ajustada em relação à linha de base | -68,0 | -60,2 | |
| Dose diária de insulina | |||
| Média basal (dose inicial) | 10 você | 10 você | |
| Dose média após 52 semanas | 56 você | 58 você | |
- *ADO: agente antidiabético oral
- **A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo D, havia 20,6% dos indivíduos nos braços TRESIBA e 22,2% dos braços Insulina glargina para os quais faltavam dados no momento da HbA1c1c medição.
Estudo E: TRESIBA U-200 administrado no mesmo horário todos os dias como um complemento à metformina com ou sem um inibidor DPP-4 em pacientes adultos virgens de insulina
A eficácia de TRESIBA U-200 foi avaliada em um estudo randomizado, aberto e multicêntrico de 26 semanas em 457 pacientes virgens de insulina com diabetes mellitus tipo 2 inadequadamente controlados com um ou mais agentes antidiabéticos orais (OADs) no início do estudo. Os pacientes foram randomizados para receber TRESIBA U-200 uma vez ao dia com o jantar ou insulina glargina U-100 uma vez ao dia de acordo com a bula aprovada. Ambos os braços de tratamento receberam metformina isoladamente (84%) ou em combinação com um inibidor DPP-4 (16%) como terapia de base.
A idade média da população experimental foi de 58 anos e a duração média do diabetes foi de 8 anos. 53% eram do sexo masculino. 78% eram brancos, 14% negros ou afro-americanos. 8% eram hispânicos. 8% dos pacientes tinham TFGe <60 mL/min/1,73m2. O IMC médio foi de aproximadamente 32,4 kg/m2.
Na semana 26, a diferença na HbA1c a redução da linha de base entre TRESIBA U-200 e insulina glargina U-100 foi de 0,04% com um intervalo de confiança de 95% de [-0.11%; 0.19%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Consulte a Tabela 10.
Tabela 10: Resultados na semana 26 em um ensaio comparando TRESIBA U-200 com insulina glargina U-100 em pacientes adultos com diabetes mellitus tipo 2 em uso de OAD(s)*
| TRESIBA U-200 + Met ± DPP-4 | Insulina glargina U-100 + Met ± DPP-4 | ||
| N | 228 | 229 | |
| HbA1c1c (%) | |||
| Linha de base | 8.3 | 8.2 | |
| Fim do julgamento | 7,0 | 6,9 | |
| Alteração média ajustada em relação à linha de base** | -1,18 | -1,22 | |
| Diferença estimada de tratamento [95%CI]
TRESIBA – Insulina glargina U-100 |
0,04 [-0.11;0.19] | ||
| Proporção de obtenção de HbA1c1c <7% no final do teste | 52,2% | 55,9% | |
| GPJ (mg/dL) | |||
| Linha de base | 172 | 174 | |
| Fim do julgamento | 106 | 113 | |
| Alteração média ajustada em relação à linha de base | -71,1 | -63,5 | |
| Dose diária de insulina | |||
| Média da linha de base | 10 você | 10 você | |
| Dose média após 26 semanas | 59 você | 62 você | |
- *ADO: agente antidiabético oral
- **A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo E, havia 12,3% dos indivíduos nos braços TRESIBA e 12,7% nos braços Insulina glargina para os quais faltavam dados no momento da HbA1c1c medição.
Estudo F: TRESIBA administrado no mesmo horário todos os dias em pacientes adultos sem experiência com insulina como complemento de um ou mais dos seguintes agentes orais: metformina, sulfonilureia, glinidas ou inibidores de alfa-glucosidase
A eficácia de TRESIBA foi avaliada em um estudo randomizado, aberto e multicêntrico de 26 semanas na Ásia em 435 pacientes virgens de insulina com diabetes mellitus tipo 2 inadequadamente controlados com um ou mais agentes antidiabéticos orais (OADs) no início do estudo. Os pacientes foram randomizados para receber TRESIBA uma vez ao dia à noite ou insulina glargina U-100 uma vez ao dia de acordo com a bula aprovada. Os agentes antidiabéticos orais pré-ensaio foram continuados como terapia de base, exceto para inibidores DPP-4 ou tiazolidinedionas em ambos os braços de tratamento.
A idade média da população experimental foi de 59 anos e a duração média do diabetes foi de 12 anos. 54% eram do sexo masculino. Todos os pacientes eram asiáticos. 11% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 25,0 kg/m2.
Na semana 26, a diferença na HbA1c a redução da linha de base entre TRESIBA e insulina glargina U-100 foi de 0,11% com um intervalo de confiança de 95% de [-0.03%; 0.24%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Consulte a Tabela 11.
Tabela 11: Resultados na Semana 26 de um Estudo Comparando TRESIBA com Insulina Glargina U-100 em Pacientes Adultos com Diabetes Mellitus Tipo 2 em uso de OAD(s)*
| TRESIBA + OAD(s)* | Insulina glargina U-100 + OAD(s)* | |
| N | 289 | 146 |
| HbA1c1c (%) | ||
| Linha de base | 8.4 | 8,5 |
| Fim do julgamento | 7.2 | 7.1 |
| Alteração média ajustada em relação à linha de base** | -1,42 | -1,52 |
| Diferença estimada de tratamento [95%CI]
TRESIBA – Insulina glargina U-100 |
0,11 [-0.03 ; 0.24] | |
| Proporção de obtenção de HbA1c1c <7% no final do teste | 40,8% | 48,6% |
| GPJ (mg/dL) | ||
| Linha de base | 152 | 156 |
| Fim do julgamento | 100 | 102 |
| Alteração média ajustada em relação à linha de base | -54,6 | -53,0 |
| Dose diária de insulina | ||
| Média basal (dose inicial) | 9 você | 9 você |
| Dose média após 26 semanas | 19 você | 24 você |
- *ADO: agente antidiabético oral
- **A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo F, havia 10% dos indivíduos nos braços TRESIBA e 6,8% nos braços Insulina glargina para os quais faltavam dados no momento da HbA1c1c medição.
Estudo G: TRESIBA administrado no mesmo horário todos os dias ou a qualquer hora todos os dias como complemento de um e até três dos seguintes agentes orais: metformina, sulfonilureia ou glinidas ou pioglitazona em pacientes adultos
A eficácia de TRESIBA foi avaliada em um estudo randomizado, aberto e multicêntrico de 26 semanas em 687 pacientes com diabetes mellitus tipo 2 inadequadamente controlados apenas com insulina basal, agentes antidiabéticos orais (OADs) isoladamente ou ambos com insulina basal e OAD. Os pacientes foram randomizados para TRESIBA injetado uma vez ao dia, no mesmo horário todos os dias (com o jantar principal), para TRESIBA injetado uma vez ao dia a qualquer hora do dia ou para insulina glargina U-100 injetada uma vez ao dia de acordo com a bula aprovada. O braço TRESIBA a qualquer hora do dia foi projetado para simular um esquema de injeção no pior cenário, alternando intervalos de dosagem curtos e longos, uma vez ao dia (ou seja, intervalos alternados de 8 a 40 horas entre as doses). TRESIBA neste braço foi administrado de manhã na segunda, quarta e sexta-feira e à noite na terça, quinta, sábado e domingo. Até três dos seguintes agentes antidiabéticos orais (metformina, sulfonilureias, glinidas ou tiazolidinedionas) foram administrados como terapia de base em ambos os braços de tratamento.
A idade média da população experimental foi de 56 anos e a duração média do diabetes foi de 11 anos. 54% eram do sexo masculino. 67% eram brancos, 3% negros ou afro-americanos. 11% eram hispânicos. 6% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 29,6 kg/m2.
Na semana 26, a diferença na HbA1c A redução da linha de base entre TRESIBA em horários alternados e insulina glargina U-100 foi de 0,04% com um intervalo de confiança de 95% de [-0.12%; 0.20%]. Esta comparação atendeu à margem de não inferioridade pré-especificada (0,4%). Consulte a Tabela 12.
Tabela 12: Resultados na semana 26 em um ensaio comparando TRESIBA em horários iguais e alternados com insulina glargina U-100 em pacientes adultos com diabetes mellitus tipo 2 em uso de OAD(s)*
| TRESIBA no mesmo horário todos os dias ± OAD(s)* |
TRESIBA em horários alternados ± OAD(s)* |
Insulina glargina U-100 ± OAD(s)* | |
| N | 228 | 229 | 230 |
| HbA1c1c (%) | |||
| Linha de base | 8.4 | 8,5 | 8.4 |
| Fim do julgamento | 7.3 | 7.2 | 7.1 |
| Alteração média ajustada em relação à linha de base** | -1.03 | -1,17 | -1,21 |
| Diferença estimada de tratamento [95%CI]
TRESIBA alternada- Insulina glargina U-100 |
0,04 [-0.12;0.20] | ||
| Diferença estimada de tratamento TRESIBA alternada – TRESIBA igual | -0,13 | ||
| Proporção de obtenção de HbA1c1c <7% no final do teste | 40,8% | 38,9% | 43,9% |
| GPJ (mg/dL) | |||
| Linha de base | 158 | 162 | 163 |
| Fim do julgamento | 105 | 105 | 112 |
| Alteração média ajustada em relação à linha de base | -54,2 | -55,0 | -47,5 |
| Dose diária de insulina | |||
| Média da linha de base | 21 você | 19 você | 19 você |
| Dose média após 26 semanas | 45 U | 46 você | 44 você |
- *ADO: agente antidiabético oral
- **A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo G, havia 11,4% de indivíduos para os braços de TRESIBA (mesmo horário e horários alternados) e 11,7% de braços de insulina glargina para os quais faltavam dados no momento da HbA1c1c medição.
Estudo H: TRESIBA administrado no mesmo horário todos os dias em combinação com um análogo de insulina de ação rápida na hora das refeições em pacientes adultos
A eficácia de TRESIBA foi avaliada em um estudo randomizado, aberto e multicêntrico de 52 semanas em 992 pacientes com diabetes mellitus tipo 2 inadequadamente controlados com insulina pré-mistura, insulina em bolus isoladamente, insulina basal isoladamente, agentes antidiabéticos orais (OADs) isolados ou qualquer combinação dos mesmos. Os pacientes foram randomizados para receber TRESIBA uma vez ao dia com a refeição principal da noite ou insulina glargina U-100 uma vez ao dia de acordo com a bula aprovada. A insulina aspártico foi administrada antes de cada refeição em ambos os braços de tratamento. Até dois dos seguintes agentes antidiabéticos orais (metformina ou pioglitazona) foram usado como terapia de base em ambos os braços de tratamento.
A idade média da população experimental foi de 59 anos e a duração média do diabetes foi de 14 anos. 54% eram do sexo masculino. 83% eram brancos, 10% negros ou afro-americanos. 12% eram hispânicos. 12% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 32,2 kg/m2.
Na semana 52, a diferença na HbA1c a redução da linha de base entre TRESIBA e insulina glargina U-100 foi de 0,08% com um intervalo de confiança de 95% de [-0.05%; 0.21%] e atendeu à margem de não inferioridade pré-especificada (0,4%). Consulte a Tabela 13.
Tabela 13: Resultados na semana 52 em um ensaio comparando TRESIBA com insulina glargina U-100 em pacientes adultos com diabetes mellitus tipo 2 que recebem insulina aspártico às refeições e ADOs*
| TRESIBA + Insulina aspártico ± OAD(s)* | Insulina glargina U-100 + Insulina aspártico ± OAD(s)* | |
| N | 744 | 248 |
| HbA1c1c (%) | ||
| Linha de base | 8.3 | 8.4 |
| Fim do julgamento | 7.1 | 7.1 |
| Alteração média ajustada em relação à linha de base** | -1,10 | -1,18 |
| Diferença estimada de tratamento [95%CI]
TRESIBA – Insulina glargina U-100 |
0,08 [-0.05;0.21] | |
| Proporção de obtenção de HbA1c1c <7% no final do teste | 49,5% | 50,0% |
| GPJ (mg/dL) | ||
| Linha de base | 166 | 166 |
| Fim do julgamento | 122 | 127 |
| Alteração média ajustada em relação à linha de base | -40,6 | -35,3 |
| Dose diária de insulina basal | ||
| Média da linha de base | 42 você | 41 você |
| Dose média após 52 semanas | 74 você | 67 você |
| Dose diária de insulina em bolus | ||
| Média da linha de base | 33 você | 33 você |
| Dose média após 52 semanas | 70 U | 73 você |
- *ADO: agente antidiabético oral
- **A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo H, havia 16,1% dos indivíduos nos braços TRESIBA e 14,5% Insulina glargina para os quais faltavam dados no momento da HbA1c1c medição.
Estudo I: TRESIBA administrado a qualquer hora do dia como complemento de um ou dois dos seguintes agentes orais: metformina, sulfonilureia ou pioglitazona em pacientes adultos
A eficácia de TRESIBA foi avaliada em um estudo randomizado, aberto e multicêntrico de 26 semanas em 447 pacientes com diabetes mellitus tipo 2 inadequadamente controlados com um ou mais agentes antidiabéticos orais (OADs) no início do estudo. Os pacientes foram randomizados para receber TRESIBA uma vez ao dia a qualquer hora do dia ou sitagliptina uma vez ao dia de acordo com a bula aprovada. Um ou dois dos seguintes agentes antidiabéticos orais (metformina, sulfonilureia ou pioglitazona) também foram administrados em ambos os braços de tratamento.
A idade média da população do estudo foi de 56 anos e a duração média do diabetes foi de 8 anos. 59% eram do sexo masculino. 61% eram brancos, 8% negros ou afro-americanos. 21% eram hispânicos. 6% dos pacientes tinham TFGe<60 mL/min/1,73m2. O IMC médio foi de aproximadamente 30,4 kg/m2.
Ao final de 26 semanas, TRESIBA proporcionou maior redução na média de HbA1c1c em comparação com a sitagliptina (p < 0,001). Consulte a Tabela 14.
Tabela 14: Resultados na semana 26 em um ensaio comparando TRESIBA com sitagliptina em pacientes adultos com diabetes mellitus tipo 2 em uso de ADOs*
| TRESIBA + OAD(s)* | Sitagliptina + ADO(s)* | |
| N | 225 | 222 |
| HbA1c1c (%) | ||
| Linha de base | 8.8 | 9,0 |
| Fim do julgamento | 7.2 | 7.7 |
| Alteração média ajustada em relação à linha de base** | -1,52 | -1.09 |
| Diferença estimada de tratamento [95%CI]
TRESIBA – Sitagliptina |
-0,43 [-0.61;-0.24]1 | |
| Proporção de obtenção de HbA1c1c <7% no final do teste | 40,9% | 27,9% |
| GPJ (mg/dL) | ||
| Linha de base | 170 | 179 |
| Fim do julgamento | 112 | 154 |
| Alteração média ajustada em relação à linha de base | -61,4 | -22,3 |
| Dose diária de insulina | ||
| Média da linha de base | 10 você | N / D |
| Dose média após 26 semanas | 43 você | N / D |
- *ADO: agente antidiabético oral
- **A mudança desde o início até a consulta de final de tratamento na HbA1c1c foi analisado usando ANOVA com tratamento, região, sexo e tratamento antidiabético na triagem como efeitos fixos, e idade e HbA1c basal1c como covariáveis.
- No Estudo I, havia 20,9% dos indivíduos nos braços TRESIBA e 22,5% Sitagliptina para os quais faltavam dados no momento da HbA1c1c medição.
- 1p<0,001; Valor p unilateral avaliado no nível de 2,5% para superioridade
14.4 Teste de Resultados de Segurança
DEVOTE (NCT01959529) Ensaio de resultados cardiovasculares de TRESIBA administrado uma vez ao dia entre o jantar e a hora de dormir em combinação com o padrão de tratamento em indivíduos com diabetes tipo 2 e doença cardiovascular aterosclerótica
DEVOTE foi um ensaio multicêntrico, multinacional, randomizado, duplo-cego, controlado por ativo, tratamento para alvo e orientado a eventos. 7.637 pacientes com diabetes tipo 2 inadequadamente controlada e doença cardiovascular aterosclerótica foram randomizados para TRESIBA ou insulina glargina U-100. Cada um foi administrado uma vez ao dia entre o jantar e a hora de dormir, além do tratamento padrão para diabetes e doenças cardiovasculares, por um período médio de 2 anos.
Os pacientes elegíveis para entrar no estudo foram; 50 anos de idade ou mais e tinham doença arterial periférica estabelecida, estável, cardiovascular, cerebrovascular, doença renal crônica ou insuficiência cardíaca classes II e III da NYHA (85% da população inscrita) ou tinham 60 anos de idade ou mais e tinham outros fatores de risco específicos para doenças cardiovasculares (15% da população inscrita).
No início do estudo, as características demográficas e da doença foram equilibradas entre os grupos de tratamento. A idade média da população experimental foi de 65 anos e a duração média do diabetes foi de 16 anos. A população era 63% masculina, 76% branca, 11% negra ou afro-americana, 10% asiática. 15% tinham etnia hispânica. A HbA média1c foi de 8,4% e o IMC médio foi de 33,6 kg/m2. A taxa média de filtração glomerular estimada (TFGe) basal foi de 68 mL/min/1,73m2. 41% dos pacientes tinham TFGe 60-90 mL/min/1,73m2; 35% dos pacientes tinham TFGe de 30 a 60 mL/min/1,73 m2 e 3% dos pacientes tinham TFGe <30 mL/min/1,73 m2. A história anterior de hipoglicemia grave não foi capturada no estudo.
No início do estudo, os pacientes trataram a diabetes com medicamentos antidiabéticos orais (72%) e com um regime de insulina (84%). Os tipos de insulinas incluíram insulina de ação prolongada (60%), insulina de ação intermediária (14%), insulina de ação curta (37%) e insulina pré-misturada (10%). 16% dos pacientes eram virgens de insulina. Os medicamentos antidiabéticos orais de base mais comuns utilizados no início do estudo foram metformina (60%), sulfonilureias (29%) e inibidores DPP-4 (12%).
Durante o estudo, os investigadores puderam modificar os medicamentos antidiabéticos e cardiovasculares para atingir as metas locais de tratamento padrão para lipídios e pressão arterial.
Resultados cardiovasculares – Pacientes com DM2 e DCV aterosclerótica
A incidência de eventos cardiovasculares maiores com TRESIBA foi avaliada no DEVOTE. Os indivíduos tratados com TRESIBA tiveram uma incidência semelhante de eventos cardiovasculares adversos maiores (MACE) quando comparados àqueles tratados com insulina glargina U-100.
O endpoint primário no DEVOTE foi o tempo desde a randomização até a primeira ocorrência de um evento cardiovascular adverso grave (MACE) de três componentes: morte cardiovascular, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal. O ensaio foi concebido para excluir uma margem de risco pré-especificada de 1,3 para a taxa de risco de MACE comparando TRESIBA com insulina glargina U-100. O resultado primário no final do ensaio estava disponível para 98,2% dos participantes em cada grupo de tratamento.
O tempo até a primeira ocorrência de MACE com TRESIBA em comparação com insulina glargina U-100 não foi inferior (HR: 0,91; IC 95% [0.78;1.06]; veja a Figura 3). Os resultados do endpoint primário composto MACE e um resumo dos seus componentes individuais são mostrados na Tabela 15.
Tabela 15: Análise do MACE Composto de 3 pontos e Endpoints Cardiovasculares Individuais no DEVOTE
| TRESIBA | Insulina glargina U-100 | ||||
| N | 3.818 | 3.819 | |||
| Número de pacientes (%) | Taxa por 100 PYO* | Número de pacientes (%) | Taxa por 100 PYO* | Taxa de risco
(IC 95%) |
|
| Composto do primeiro evento de morte CV, IM não fatal ou AVC não fatal (MACE de 3 pontos) | 325 (8,5) | 4.41 | 356 (9,3) | 4,86 | 0,91
[0.78; 1.06] |
| Morte CV | 136 (3,6) | 1,85 | 142 (3,7) | 1,94 | |
| IM não fatal | 144 (3,8) | 1,95 | 169 (4,4) | 2.31 | |
| AVC não fatal | 71 (1,9) | 0,96 | 79 (2.1) | 1.08 | |
*PYO = paciente-anos de observação até o primeiro MACE, morte ou descontinuação do estudo
Figura 3: Probabilidade de evento cumulativo para o tempo até o primeiro MACE no DEVOTE
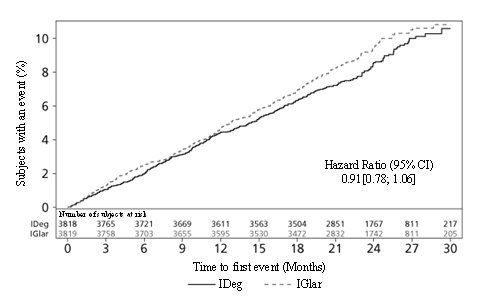
Resultados de hipoglicemia – Pacientes com DM2 e DCV aterosclerótica
Os desfechos secundários pré-especificados de eventos e taxas de incidência de hipoglicemia grave foram testados sequencialmente.
A hipoglicemia grave foi definida como um episódio que requer assistência de outra pessoa para administrar ativamente carboidratos, glucagon ou outras ações de ressuscitação e durante o qual a concentração de glicose plasmática pode não estar disponível, mas onde a recuperação neurológica após o retorno da glicose plasmática ao normal foi considerada suficiente evidência de que o evento foi induzido por uma baixa concentração de glicose plasmática.
A incidência de hipoglicemia grave foi menor no grupo TRESIBA em comparação com o grupo insulina glargina U-100 (Tabela 16). O controle glicêmico entre os dois grupos foi semelhante no início e durante todo o estudo.
Tabela 16: Episódios hipoglicêmicos graves em pacientes tratados com TRESIBA ou insulina glargina U-100 no DEVOTE
| TRESIBA | Insulina glargina U-100 | |
| N | 3.818 | 3.819 |
| Hipoglicemia grave | ||
| Porcentagem de pacientes com eventos | 4,9% | 6,6% |
| Proporção de probabilidades estimada [95%CI] TRESIBA/Insulina glargina U-100 | 0,73 [0.60; 0.89]* | |
| Eventos por 100 pacientes-anos de observação | 3,70 | 6,25 |
| Proporção de taxa estimada [95%CI] TRESIBA/Insulina glargina U-100 | 0,60 [0.48; 0.76]* | |
*Teste de superioridade avaliado em nível de 5% de significância, (p<0,001 bilateral)
16. Como é fornecido o Tresiba
16.1 Como é fornecido
A injeção de TRESIBA (insulina degludec) está disponível como uma solução límpida e incolor da seguinte forma:
Tabela 17: Apresentações do TRESIBA
| Apresentação TRESIBA | Volume total | Concentração | Total de unidades disponíveis na apresentação | Número NDC | Dose máxima por injeção | Incremento de dose | tamanho do pacote |
| Sub-100
Caneta FlexTouch para uso em um único paciente |
3ml | 100 unidades/mL | 300 unidades | 0169-2660-15 | 80 unidades | 1 unidade | 5 canetas/pacote |
| Sub-100
dose múltipla Frasco |
10ml | 100 unidades/mL | 1.000 unidades | 0 169-2662-11 | _ | _ | 1 frasco/pacote |
| Sub-200
Caneta FlexTouch para uso em um único paciente |
3ml | 200 unidades/mL | 600 unidades | 0169-2550-13 | 160 unidades | 2 unidades | 3 canetas/pacote |
Informações adicionais sobre TRESIBA FlexTouch:
- •
- A caneta TRESIBA U-100 FlexTouch disca em incrementos de 1 unidade.
- •
- A caneta TRESIBA U-200 FlexTouch disca em incrementos de 2 unidades.
16.2 Armazenamento Recomendado
Dispense na embalagem original lacrada com as instruções de uso em anexo.
Conservar os frascos para injetáveis de TRESIBA na embalagem original para proteger da luz. Guarde TRESIBA não utilizado na geladeira (36ºF a 46ºF [2ºC to 8ºC]). Não guarde no freezer ou diretamente próximo ao elemento de resfriamento do refrigerador. Não congele. Não use TRESIBA se estiver congelado.
As condições de armazenamento estão resumidas na Tabela 18:
Tabela 18: Condições de armazenamento para TRESIBA
| Não em uso (fechado) | Em uso (aberto) | |||
| Refrigerado (36°F a 46°F [2°C to 8°C]) |
Temperatura do quarto (até 86°F [30°C]) |
Temperatura do quarto (até 86°F [30°C]) |
Refrigerado (36°F a 46°F [2°C to 8°C]) |
|
| 3 mL de TRESIBA para uso em um único paciente U-100 FlexTouch |
Até a data de vencimento | 56 dias (8 semanas) |
56 dias (8 semanas) |
56 dias
(8 semanas) |
| 10 mL em dose múltipla
TRESIBA Frasco U-100 |
Até a data de vencimento | 56 dias (8 semanas) |
56 dias (8 semanas) |
56 dias
(8 semanas) |
| 3 mL de TRESIBA para uso em um único paciente U-200 FlexTouch |
Até a data de vencimento | 56 dias (8 semanas) |
56 dias (8 semanas) |
56 dias
(8 semanas) |
17. Informações de aconselhamento ao paciente
Aconselhe o paciente e/ou cuidador a ler a rotulagem do paciente aprovada pela FDA (Informações do paciente e instruções de uso). Existem instruções de uso separadas para os frascos e canetas FlexTouch.
Nunca compartilhe uma caneta, agulha ou seringa de insulina TRESIBA FlexTouch entre pacientes
Aconselhe os pacientes que eles nunca devem compartilhar um dispositivo de caneta TRESIBA FlexTouch com outra pessoa, mesmo que a agulha seja trocada. Aconselhe os pacientes que usam frascos para injetáveis de TRESIBA a não compartilhar agulhas ou seringas de insulina com outra pessoa. Compartilhar representa um risco de transmissão de patógenos transmitidos pelo sangue.
Hiperglicemia ou Hipoglicemia
Informe os pacientes que a hipoglicemia é a reação adversa mais comum com a insulina. Informe os pacientes sobre os sintomas de hipoglicemia (por exemplo, capacidade prejudicada de concentração e reação. Isso pode representar um risco em situações em que essas habilidades são especialmente importantes, como dirigir ou operar outras máquinas. Aconselhe os pacientes que apresentam hipoglicemia frequente ou aviso reduzido ou ausente sinais de hipoglicemia para ter cuidado ao dirigir ou operar máquinas.
Avise os pacientes que alterações no regime de insulina podem predispor à hiperglicemia ou hipoglicemia e que as alterações no regime de insulina devem ser feitas sob rigorosa supervisão médica.
Hipoglicemia devido a erros de medicação
Informe os pacientes para sempre verificarem o rótulo da insulina antes de cada injeção para reduzir o risco de erro de medicação. Informe os pacientes que o contador de doses da caneta TRESIBA FlexTouch mostra o número de unidades de TRESIBA a serem injetadas. NÃO é necessário recálculo da dose. Instrua os pacientes a nunca usar uma seringa para remover TRESIBA da caneta pré-cheia de insulina descartável FlexTouch.
Reações de hipersensibilidade
Avise os pacientes que ocorreram reações de hipersensibilidade com TRESIBA. Informar os pacientes sobre os sintomas de reações de hipersensibilidade.

