Bula/rótulo do produto
Nome genérico: succinato de sumatriptano
Forma farmacêutica: comprimido, revestido por película
Classe de drogas: Agentes antienxaqueca
1. Indicações e uso do Sumatriptano
Os comprimidos de sumatriptano são indicados para o tratamento agudo da enxaqueca com ou sem aura em adultos.
Limitações de uso:
- Use somente se um diagnóstico claro de enxaqueca tiver sido estabelecido. Se um paciente não responder à primeira crise de enxaqueca tratada com sumatriptano, reconsidere o diagnóstico de enxaqueca antes de administrar sumatriptano para tratar quaisquer crises subsequentes.
- O sumatriptano não está indicado na prevenção de crises de enxaqueca.
- A segurança e a eficácia dos comprimidos de sumatriptano não foram estabelecidas para cefaléia em salvas.
2. Dosagem e administração de sumatriptano
2.1 Informações sobre dosagem
A dose recomendada de comprimidos de sumatriptano é 25 mg, 50 mg ou 100 mg. Doses de 50 mg e 100 mg podem proporcionar um efeito maior do que a dose de 25 mg, mas doses de 100 mg podem não proporcionar um efeito maior do que a dose de 50 mg. Doses mais altas podem ter um risco maior de reações adversas.
Se a enxaqueca não desaparecer 2 horas após a ingestão dos comprimidos de sumatriptano, ou retornar após uma melhora transitória, uma segunda dose poderá ser administrada pelo menos 2 horas após a primeira dose. A dose diária máxima é de 200 mg num período de 24 horas.
Uso após injeção de sumatriptano
Se a enxaqueca retornar após um tratamento inicial com injeção de sumatriptano, comprimidos únicos adicionais de sumatriptano (até 100 mg/dia) podem ser administrados com um intervalo de pelo menos 2 horas entre as doses dos comprimidos.
A segurança do tratamento de uma média de mais de 4 dores de cabeça num período de 30 dias não foi estabelecida.
2.2 Posologia em Pacientes com Insuficiência Hepática
Se o tratamento for considerado aconselhável na presença de insuficiência hepática ligeira a moderada, a dose única máxima não deve exceder 50 mg.
3. Formas farmacêuticas e dosagens
Comprimidos de 25 mg: de cor amarela, revestido por película, triangular biconvexo com a gravação “S” de um lado e “102” do outro lado.
Comprimidos de 50 mg: de cor rosa, revestido por película, triangular biconvexo com a gravação “S” de um lado e “103” do outro lado.
Comprimidos de 100 mg: branco a esbranquiçado, revestido por película, triangular biconvexo com a gravação “S” de um lado e “104” do outro lado.
4. Contra-indicações
Os comprimidos de sumatriptano são contra-indicados em pacientes com:
- Doença arterial coronariana isquêmica (DAC) (angina de peito, história de infarto do miocárdio ou isquemia silenciosa documentada) ou vasoespasmo da artéria coronária, incluindo angina de Prinzmetal.
- Síndrome de Wolff-Parkinson-White ou arritmias associadas a outros distúrbios da via de condução acessória cardíaca.
- História de acidente vascular cerebral ou ataque isquêmico transitório (AIT) ou história de enxaqueca hemiplégica ou basilar porque esses pacientes apresentam maior risco de acidente vascular cerebral
- Doença vascular periférica
- Doença intestinal isquêmica
- Hipertensão não controlada
- Uso recente (ou seja, dentro de 24 horas) de medicamentos contendo ergotamina, medicamentos do tipo ergotamina (como diidroergotamina ou metisergida) ou outra 5-hidroxitriptamina1 (5-HT1) agonista
- Administração concomitante de um inibidor da monoamina oxidase (MAO)-A ou uso recente (dentro de 2 semanas) de um inibidor da MAO-A
- Hipersensibilidade ao sumatriptano (angioedema e anafilaxia observados)
- Insuficiência hepática grave
5. Advertências e precauções
5.1 Isquemia Miocárdica, Infarto do Miocárdio e Angina de Prinzmetal
O uso de comprimidos de sumatriptana é contraindicado em pacientes com DAC isquêmica ou vasospástica. Houve raros relatos de reações adversas cardíacas graves, incluindo infarto agudo do miocárdio, ocorrendo poucas horas após a administração de comprimidos de sumatriptano. Algumas destas reações ocorreram em pacientes sem DAC conhecida. Os comprimidos de sumatriptano podem causar vasoespasmo da artéria coronária (angina de Prinzmetal), mesmo em pacientes sem histórico de DAC.
Realize uma avaliação cardiovascular em pacientes que não receberam triptano e que apresentam múltiplos fatores de risco cardiovascular (por exemplo, aumento da idade, diabetes, hipertensão, tabagismo, obesidade, forte histórico familiar de DAC) antes de receber comprimidos de sumatriptano. Se houver evidência de DAC ou vasoespasmo da artéria coronária, os comprimidos de sumatriptano são contraindicados. Para pacientes com múltiplos fatores de risco cardiovascular que apresentam avaliação cardiovascular negativa, considere administrar a primeira dose de comprimidos de sumatriptano em ambiente supervisionado por um médico e realizar um eletrocardiograma (ECG) imediatamente após a administração de comprimidos de sumatriptano. Para esses pacientes, considerar avaliação cardiovascular periódica em usuários intermitentes de comprimidos de sumatriptano por longo prazo.
5.2 Arritmias
Distúrbios do ritmo cardíaco com risco de vida, incluindo taquicardia ventricular e fibrilação ventricular levando à morte, foram relatados poucas horas após a administração de 5-HT1 agonistas. Interrompa os comprimidos de sumatriptano se esses distúrbios ocorrerem. Os comprimidos de sumatriptano são contraindicados em pacientes com síndrome de Wolff-Parkinson-White ou arritmias associadas a outros distúrbios da via de condução acessória cardíaca.
5.3 Dor/aperto/pressão no peito, garganta, pescoço e/ou mandíbula
Sensações de aperto, dor, pressão e peso no precórdio, garganta, pescoço e mandíbula geralmente ocorrem após o tratamento com comprimidos de sumatriptano e geralmente são de origem não cardíaca. No entanto, realize uma avaliação cardíaca se esses pacientes apresentarem alto risco cardíaco. O uso de comprimidos de sumatriptano é contraindicado em pacientes com DAC e naqueles com angina variante de Prinzmetal.
5.4 Eventos Cerebrovasculares
Hemorragia cerebral, hemorragia subaracnóidea e acidente vascular cerebral ocorreram em pacientes tratados com 5-HT1 agonistas, e alguns resultaram em mortes. Em vários casos, parece possível que os acontecimentos cerebrovasculares tenham sido primários, a 5-HT1 agonista tendo sido administrado na crença incorreta de que os sintomas experimentados eram uma consequência da enxaqueca, quando não eram. Além disso, pacientes com enxaqueca podem apresentar risco aumentado de certos eventos cerebrovasculares (por exemplo, acidente vascular cerebral, hemorragia, AIT). Suspenda os comprimidos de sumatriptano se ocorrer um evento cerebrovascular.
Antes de tratar dores de cabeça em pacientes não previamente diagnosticados como enxaquecosos e em enxaquecas que apresentam sintomas atípicos, exclua outras condições neurológicas potencialmente graves. Os comprimidos de sumatriptano são contra-indicados em pacientes com histórico de acidente vascular cerebral ou AIT.
5.5 Outras reações de vasoespasmo
Os comprimidos de sumatriptano podem causar reações vasospásticas não coronarianas, como isquemia vascular periférica, isquemia vascular gastrointestinal e infarto (apresentando dor abdominal e diarreia com sangue), infarto esplênico e síndrome de Raynaud. Em pacientes que apresentam sintomas ou sinais sugestivos de reação de vasoespasmo não coronariano após o uso de qualquer 5-HT1 agonista, descarte uma reação vasospástica antes de receber comprimidos adicionais de sumatriptano.
Relatos de cegueira transitória e permanente e perda parcial significativa de visão foram relatados com o uso de 5-HT1 agonistas. Como os distúrbios visuais podem fazer parte de uma crise de enxaqueca, uma relação causal entre esses eventos e o uso de 5-HT1 agonistas não foi claramente estabelecida.
5.6 Dor de cabeça por uso excessivo de medicamentos
O uso excessivo de medicamentos para enxaqueca aguda (por exemplo, ergotamina, triptanos, opioides ou uma combinação desses medicamentos por 10 ou mais dias por mês) pode levar à exacerbação da dor de cabeça (cefaléia por uso excessivo de medicamentos). A cefaleia por uso excessivo de medicamentos pode se apresentar como dores de cabeça diárias semelhantes às da enxaqueca ou como um aumento acentuado na frequência das crises de enxaqueca. Pode ser necessária a desintoxicação dos pacientes, incluindo a retirada dos medicamentos usados em excesso e o tratamento dos sintomas de abstinência (que muitas vezes incluem um agravamento transitório da dor de cabeça).
5.7 Síndrome da serotonina
A síndrome da serotonina pode ocorrer com comprimidos de sumatriptano, particularmente durante a administração concomitante com inibidores seletivos da recaptação da serotonina (ISRS), inibidores da recaptação da serotonina e noradrenalina (SNRIs), antidepressivos tricíclicos (ADTs) e inibidores da MAO.. Os sintomas da síndrome serotoninérgica podem incluir alterações do estado mental (por exemplo, agitação, alucinações, coma), instabilidade autonômica (por exemplo, taquicardia, pressão arterial lábil, hipertermia), aberrações neuromusculares (por exemplo, hiperreflexia, incoordenação) e/ou sintomas gastrointestinais (por exemplo, náuseas, vómitos, diarreia). O início dos sintomas geralmente ocorre minutos a horas após o recebimento de uma dose nova ou maior de um medicamento serotoninérgico. Suspenda os comprimidos de sumatriptano se houver suspeita de síndrome da serotonina.
5.8 Aumento da Pressão Arterial
Elevação significativa da pressão arterial, incluindo crise hipertensiva com comprometimento agudo de sistemas orgânicos, foi relatada em raras ocasiões em pacientes tratados com agonistas 5-HT1, incluindo pacientes sem histórico de hipertensão. Monitore a pressão arterial em pacientes tratados com sumatriptano. Os comprimidos de sumatriptano são contraindicados em pacientes com hipertensão não controlada.
5.9 Reações Anafiláticas/Anafilactóides
Ocorreram reações anafiláticas/anafilactóides em pacientes recebendo sumatriptano. Tais reações podem ser fatais ou fatais. Em geral, as reações anafiláticas a medicamentos são mais prováveis de ocorrer em indivíduos com histórico de sensibilidade a múltiplos alérgenos. Os comprimidos de sumatriptano são contra-indicados em pacientes com histórico de reação de hipersensibilidade ao sumatriptano.
5.10 Convulsões
Foram relatadas convulsões após a administração de sumatriptano. Alguns ocorreram em pacientes com histórico de convulsões ou condições concomitantes que predispõem a convulsões. Há também relatos de pacientes onde nenhum desses fatores predisponentes é aparente. Os comprimidos de sumatriptano devem ser usados com cautela em pacientes com histórico de epilepsia ou condições associadas a um limiar convulsivo reduzido.
6. Reações adversas/efeitos colaterais
As seguintes reações adversas são discutidas com mais detalhes em outras seções das informações de prescrição:
- Isquemia miocárdica, infarto do miocárdio e angina de Prinzmetal
- Arritmias
- Dor/aperto/pressão no peito, garganta, pescoço e/ou mandíbula
- Eventos cerebrovasculares
- Outras reações de vasoespasmo
- Dor de cabeça por uso excessivo de medicamentos
- Síndrome da serotonina
- Aumento da pressão arterial
- Reações de hipersensibilidade
- Convulsões
6.1 Experiência em Ensaios Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
A Tabela 1 lista as reações adversas que ocorreram em ensaios clínicos controlados por placebo em pacientes que tomaram pelo menos 1 dose do medicamento em estudo. Apenas as reações adversas emergentes do tratamento que ocorreram com uma frequência de 2% ou mais em qualquer grupo tratado com comprimidos de sumatriptano e que ocorreram com uma frequência superior à do grupo placebo estão incluídas na Tabela 1.
Tabela 1. Reações adversas relatadas por pelo menos 2% dos pacientes tratados com comprimidos de sumatriptano e com maior frequência que placebo
| Reação adversa | Porcentagem de pacientes relatando | ||||
| Comprimidos de sumatriptano 25mg (n = 417) |
Comprimidos de sumatriptano 50mg (n = 771) |
Comprimidos de sumatriptano 100mg (n = 437) |
Placebo (n = 309) |
||
| Sensações atípicas | 5 | 6 | 6 | 4 | |
| Parestesia (todos os tipos) | 3 | 5 | 3 | 2 | |
| Sensação de calor/frio | 3 | 2 | 3 | 2 | |
| Dor e outras sensações de pressão | 6 | 6 | 8 | 4 | |
| Peito – dor/aperto/ pressão e/ou peso |
1 | 2 | 2 | 1 | |
| Pescoço/garganta/mandíbula – dor/ aperto/pressão |
<1 | 2 | 3 | <1 | |
| Dor – localização especificada | 2 | 1 | 1 | 1 | |
| Outros – pressão/aperto/ peso |
1 | 1 | 3 | 2 | |
| Neurológico | |||||
| Vertigem | <1 | <1 | 2 | <1 | |
| Outro | |||||
| Mal-estar/fadiga | 2 | 2 | 3 | <1 | |
A incidência de reações adversas em ensaios clínicos controlados não foi afetada pelo sexo ou idade dos pacientes. Não havia dados suficientes para avaliar o impacto da raça na incidência de reações adversas.
6.2 Experiência pós-comercialização
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de comprimidos de sumatriptano, spray nasal de sumatriptano e injeção de sumatriptano. Como estas reações são notificadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança a sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Estas reações foram escolhidas para inclusão devido à sua gravidade, frequência de notificação ou ligação causal ao sumatriptano ou a uma combinação destes fatores.
Cardiovascular
Hipotensão, palpitações.
Neurológico
Distonia, tremor.
7. Interações medicamentosas
7.1 Medicamentos contendo cravagem
Foi relatado que medicamentos contendo ergot causam reações vasoespásticas prolongadas. Como esses efeitos podem ser aditivos, o uso de medicamentos contendo ergotamina ou do tipo ergotamina (como diidroergotamina ou metisergida) e comprimidos de sumatriptano com intervalo de 24 horas entre eles é contra-indicado.
7.2 Inibidores da Monoamina Oxidase-A
Os inibidores da MAO-A aumentam a exposição sistémica em 7 vezes. Portanto, o uso de comprimidos de sumatriptano em pacientes recebendo inibidores da MAO-A é contraindicado.
7.3 Outros Agonistas 5-HT1
Dado que os seus efeitos vasoespásticos podem ser aditivos, a administração concomitante de comprimidos de sumatriptano e outros 5-HT1 agonistas (por exemplo, triptanos) com intervalo de 24 horas um do outro é contra-indicado.
7.4 Inibidores Seletivos de Recaptação de Serotonina/Inibidores Seletivos de Recaptação de Serotonina e Norepinefrina e Síndrome de Serotonina
Casos de síndrome da serotonina foram relatados durante a administração concomitante de triptanos e ISRSs, IRSNs, ADTs e inibidores da MAO.
8. Uso em populações específicas
8.1 Gravidez
Resumo de riscos
Dados de um registro prospectivo de exposição na gravidez e estudos epidemiológicos de mulheres grávidas não detectaram um aumento na frequência de defeitos congênitos ou um padrão consistente de defeitos congênitos entre mulheres expostas ao sumatriptano em comparação com a população em geral (ver dados). Em estudos de toxicidade no desenvolvimento em ratos e coelhos, a administração oral de sumatriptano a animais grávidas foi associada a embrioletalidade, anomalias fetais e mortalidade de filhotes. Quando administrado por via intravenosa a coelhas grávidas, o sumatriptano foi embrioletal (ver dados).
Na população geral dos EUA, o risco estimado de defeitos congênitos graves e de aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente. A taxa relatada de defeitos congênitos graves entre partos de mulheres com enxaqueca variou de 2,2% a 2,9% e a taxa relatada de aborto espontâneo foi de 17%, que foi semelhante às taxas relatadas em mulheres sem enxaqueca.
Considerações Clínicas
Risco Materno e/ou Embrião/Fetal Associado à Doença: Vários estudos sugeriram que mulheres com enxaqueca podem ter risco aumentado de pré-eclâmpsia durante a gravidez.
Dados
Dados Humanos: O Registro de Gravidez Sumatriptano/Naratriptano/Treximet (sumatriptano e naproxeno sódico), um estudo prospectivo internacional de base populacional, coletou dados para o sumatriptano de janeiro de 1996 a setembro de 2012. O Registro documentou os resultados de 626 bebês e fetos expostos ao sumatriptano durante a gravidez (528 com exposição mais precoce durante o primeiro trimestre, 78 durante o segundo trimestre, 16 durante o terceiro trimestre e 4 desconhecidos). A ocorrência de defeitos congênitos importantes (excluindo mortes fetais e abortos induzidos sem defeitos relatados e todas as perdas espontâneas de gravidez) durante a exposição ao sumatriptano no primeiro trimestre foi de 4,2% (20/478 [95% CI: 2.6% to 6.5%]) e durante qualquer trimestre de exposição foi de 4,2% (24/576 [95% CI: 2.7% to 6.2%]). O tamanho da amostra neste estudo teve poder de 80% para detectar pelo menos um aumento de 1,73 a 1,91 vezes na taxa de malformações maiores. O número de resultados de gravidez expostos acumulados durante o registo foi insuficiente para apoiar conclusões definitivas sobre o risco global de malformações ou para fazer comparações das frequências de defeitos congénitos específicos. Dos 20 bebês com defeitos congênitos relatados após exposição ao sumatriptano no primeiro trimestre, 4 bebês tiveram defeitos do septo ventricular, incluindo um bebê que foi exposto ao sumatriptano e ao naratriptano, e 3 bebês tiveram estenose pilórica. Nenhum outro defeito congênito foi relatado em mais de 2 bebês neste grupo.
Num estudo que utilizou dados do Registo Médico de Nascimentos Sueco, os nados-vivos de mulheres que relataram ter utilizado triptanos ou ergotaminas durante a gravidez foram comparados com os de mulheres que não o fizeram. Dos 2.257 nascimentos com exposição ao sumatriptano no primeiro trimestre, 107 bebês nasceram com malformações (risco relativo 0,99 [95% CI: 0.91 to 1.21]). Um estudo usando dados vinculados do Registro Médico de Nascimento da Noruega ao Banco de Dados de Prescrição Norueguês comparou os resultados da gravidez em mulheres que resgataram prescrições de triptanos durante a gravidez, bem como um grupo de comparação de enxaqueca que resgatou prescrições de sumatriptano apenas antes da gravidez, em comparação com um grupo de comparação de doenças de enxaqueca que resgatou prescrições de sumatriptano apenas antes da gravidez. grupo de controle populacional. Das 415 mulheres que resgataram as prescrições de sumatriptano durante o primeiro trimestre, 15 tiveram bebês com malformações congênitas graves (OR 1,16 [95% CI: 0.69 to 1.94]), enquanto para as 364 mulheres que resgataram as prescrições de sumatriptano antes, mas não durante a gravidez, 20 tiveram bebês com malformações congênitas graves (OR 1,83 [95% CI: 1.17 to 2.88]), cada um comparado com o grupo de comparação populacional. Estudos observacionais adicionais menores que avaliaram o uso de sumatriptano durante a gravidez não sugeriram um risco aumentado de teratogenicidade.
Dados de animais: A administração oral de sumatriptano a ratas grávidas durante o período de organogênese resultou em um aumento na incidência de anormalidades nos vasos sanguíneos fetais (cervicotorácicos e umbilicais). A dose mais elevada sem efeito para toxicidade do desenvolvimento embriofetal em ratos foi de 60 mg/kg/dia, ou aproximadamente 3 vezes a dose humana máxima recomendada (MRHD) de 200 mg/dia numa dose de mg/m2 base. A administração oral de sumatriptano a coelhas grávidas durante o período de organogênese resultou em aumento da incidência de embrioletalidade e anormalidades vasculares e esqueléticas cervicotorácicas fetais. A administração intravenosa de sumatriptano a coelhas grávidas durante o período de organogênese resultou em um aumento na incidência de embrioletalidade. As doses orais e intravenosas sem efeito mais altas para toxicidade de desenvolvimento em coelhos foram 15 (aproximadamente 2 vezes o MRHD em mg/m2 base) e 0,75 mg/kg/dia, respectivamente.
A administração oral de sumatriptano a ratos antes e durante a gestação resultou em toxicidade embriofetal (diminuição do peso corporal, diminuição da ossificação, aumento da incidência de anomalias esqueléticas). A dose mais alta sem efeito foi de 50 mg/kg/dia, ou aproximadamente 2 vezes o MRHD em mg/m2 base. Na prole de ratas grávidas tratadas por via oral com sumatriptano durante a organogênese, houve uma diminuição na sobrevivência dos filhotes. A dose mais alta sem efeito para este efeito foi de 60 mg/kg/dia, ou aproximadamente 3 vezes o MRHD em mg/m2 base. O tratamento oral de ratas grávidas com sumatriptano durante a última parte da gestação e durante a lactação resultou em uma diminuição na sobrevivência dos filhotes. A dose mais alta sem efeito para esse achado foi de 100 mg/kg/dia, ou aproximadamente 5 vezes o MRHD em mg/m2 base.
8.2 Lactação
Resumo de riscos
O sumatriptano é excretado no leite humano após administração subcutânea (ver Dados). Não há informações sobre as concentrações de sumatriptano no leite de mulheres lactantes após a administração de comprimidos de sumatriptano. Não existem dados sobre os efeitos do sumatriptano no lactente ou sobre os efeitos do sumatriptano na produção de leite.
Os benefícios da amamentação para o desenvolvimento e a saúde devem ser considerados juntamente com a necessidade clínica da mãe de comprimidos de sumatriptano e quaisquer efeitos adversos potenciais do sumatriptano ou da condição materna subjacente no bebê amamentado.
Considerações Clínicas
A exposição infantil ao sumatriptano pode ser minimizada evitando a amamentação por 12 horas após o tratamento com comprimidos de sumatriptano.
Dados
Após administração subcutânea de uma dose de 6 mg de sumatriptano injetável em 5 voluntárias lactantes, o sumatriptano estava presente no leite.
8.4 Uso Pediátrico
A segurança e a eficácia em pacientes pediátricos não foram estabelecidas. Os comprimidos de sumatriptano não são recomendados para uso em pacientes com menos de 18 anos de idade.
Dois ensaios clínicos controlados avaliaram o spray nasal de sumatriptano (5 a 20 mg) em 1.248 adolescentes com enxaqueca com idades entre 12 e 17 anos que trataram um único ataque. Os ensaios não estabeleceram a eficácia do spray nasal de sumatriptano em comparação com o placebo no tratamento da enxaqueca em adolescentes. As reações adversas observadas nestes ensaios clínicos foram de natureza semelhante às relatadas em ensaios clínicos em adultos.
Cinco ensaios clínicos controlados (2 ensaios de ataque único, 3 ensaios de ataque múltiplo) avaliando sumatriptano oral (25 a 100 mg) em pacientes pediátricos com idade entre 12 e 17 anos inscreveram um total de 701 adolescentes com enxaqueca. Estes ensaios não estabeleceram a eficácia do sumatriptano oral em comparação com o placebo no tratamento da enxaqueca em adolescentes. As reações adversas observadas nestes ensaios clínicos foram de natureza semelhante às relatadas em ensaios clínicos em adultos. A frequência de todas as reações adversas nestes doentes pareceu depender tanto da dose como da idade, com os doentes mais jovens a reportar reações mais frequentemente do que os adolescentes mais velhos.
A experiência pós-comercialização documenta que ocorreram reações adversas graves na população pediátrica após o uso de sumatriptano subcutâneo, oral e/ou intranasal. Esses relatos incluem reações de natureza semelhante àquelas relatadas raramente em adultos, incluindo acidente vascular cerebral, perda visual e morte. Foi notificado um enfarte do miocárdio num homem de 14 anos de idade após a utilização de sumatriptano oral; os sinais clínicos ocorreram dentro de 1 dia após a administração do medicamento. Dados clínicos para determinar a frequência de reações adversas graves em pacientes pediátricos que podem receber sumatriptano subcutâneo, oral ou intranasal não estão atualmente disponíveis.
8.5 Uso Geriátrico
Os ensaios clínicos com comprimidos de sumatriptano não incluíram um número suficiente de doentes com idade igual ou superior a 65 anos para determinar se respondem de forma diferente dos doentes mais jovens. Outra experiência clínica relatada não identificou diferenças nas respostas entre pacientes idosos e mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior do intervalo posológico, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Uma avaliação cardiovascular é recomendada para pacientes geriátricos que apresentam outros fatores de risco cardiovascular (por exemplo, diabetes, hipertensão, tabagismo, obesidade, forte histórico familiar de DAC) antes de receber comprimidos de sumatriptano.
8.6 Insuficiência Hepática
A dose única máxima em pacientes com a insuficiência hepática leve a moderada não deve exceder 50 mg. Os comprimidos de sumatriptano são contraindicados em pacientes com insuficiência hepática grave.
10. Sobredosagem
Os pacientes em ensaios clínicos (N = 670) receberam doses orais únicas de 140 a 300 mg sem reações adversas significativas. Os voluntários (N = 174) receberam doses orais únicas de 140 a 400 mg sem reações adversas graves.
A sobredosagem em animais foi fatal e foi anunciada por convulsões, tremores, paralisia, inatividade, ptose, eritema das extremidades, respiração anormal, cianose, ataxia, midríase, salivação e lacrimejamento.
A meia-vida de eliminação do sumatriptano é de aproximadamente 2,5 horas e, portanto, o monitoramento dos pacientes após overdose com comprimidos de sumatriptano deve continuar por pelo menos 12 horas ou enquanto os sintomas ou sinais persistirem.
Não se sabe qual o efeito da hemodiálise ou diálise peritoneal nas concentrações séricas de sumatriptano.
11. Descrição do sumatriptano
Os comprimidos de sumatriptano, USP, contêm succinato de sumatriptano USP, um 5-HT seletivo1B/1D agonista do receptor. Succinato de sumatriptano, USP é quimicamente designado como 3-[2-(dimethylamino)ethyl]-Succinato de N-metil-indole-5-metanossulfonamida (1:1), e possui a seguinte estrutura: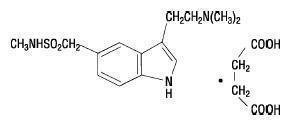
A fórmula molecular é C14H21N3Ó2S•C4H6Ó4, representando um peso molecular de 413,5. Succinato de sumatriptano, USP, é um pó branco a esbranquiçado que é facilmente solúvel em água e solução salina.
Cada comprimido de sumatriptano, USP para administração oral contém 35, 70 ou 140 mg de succinato de sumatriptano, USP equivalente a 25, 50 ou 100 mg de sumatriptano, respectivamente. Cada comprimido também contém os ingredientes inativos croscarmelose sódica, fosfato de cálcio dibásico, estearato de magnésio, celulose microcristalina, bicarbonato de sódio e opadry. Os componentes do opadry amarelo utilizados na formulação dos comprimidos de 25 mg são hipromelose, dióxido de titânio, polietilenoglicol 6000, óxido de ferro amarelo e polissorbato 80. Os componentes do opadry rosa utilizados na formulação dos comprimidos de 50 mg são hipromelose, dióxido de titânio, polietilenoglicol 400 e óxido de ferro vermelho. Os componentes do opadry white utilizados na formulação dos comprimidos de 100 mg são hipromelose, dióxido de titânio e polietilenoglicol 400.
12. Sumatriptano – Farmacologia Clínica
12.1 Mecanismo de Ação
O sumatriptano liga-se com alta afinidade ao 5-HT clonado humano1B/1D receptores. Presumivelmente, o sumatriptano exerce os seus efeitos terapêuticos no tratamento da enxaqueca através de efeitos agonistas no 5-HT1B/1D receptores nos vasos sanguíneos intracranianos e nervos sensoriais do sistema trigêmeo, que resultam na constrição dos vasos cranianos e na inibição da liberação de neuropeptídeos pró-inflamatórios.
12.2 Farmacodinâmica
Pressão arterial
Elevação significativa da pressão arterial, incluindo crise hipertensiva, foi relatada em pacientes com e sem histórico de hipertensão.
Artérias periféricas (pequenas)
Em voluntários saudáveis (N = 18), um ensaio que avaliou os efeitos do sumatriptano na reatividade arterial periférica (pequenos vasos) não conseguiu detectar um aumento clinicamente significativo na resistência periférica.
Frequência cardíaca
Os aumentos transitórios da pressão arterial observados em alguns pacientes em ensaios clínicos realizados durante o desenvolvimento do sumatriptano como tratamento para a enxaqueca não foram acompanhados por quaisquer alterações clinicamente significativas na frequência cardíaca.
12.3 Farmacocinética
Absorção
A concentração máxima média após administração oral de 25 mg é de 18 ng/mL (intervalo: 7 a 47 ng/mL) e 51 ng/mL (intervalo: 28 a 100 ng/mL) após administração oral de 100 mg de sumatriptano. Isso se compara a um Cmáx. de 5 e 16 ng/mL após administração com uma dose intranasal de 5 e 20 mg, respectivamente. A média Cmáx. após uma injeção subcutânea de 6 mg é de 71 ng/mL (intervalo: 49 a 110 ng/mL). A biodisponibilidade é de aproximadamente 15%, principalmente devido ao metabolismo pré-sistêmico e em parte devido à absorção incompleta. O Cmáx. é semelhante durante uma crise de enxaqueca e durante um período sem enxaqueca, mas o Tmáx. ocorre um pouco mais tarde durante o ataque, aproximadamente 2,5 horas em comparação com 2,0 horas. Quando administrado em dose única, o sumatriptano apresenta proporcionalidade à dose em sua extensão de absorção (área sob a curva [AUC]) na faixa de dose de 25 a 200 mg, mas a Cmáx. após 100 mg é aproximadamente 25% menor do que o esperado (com base na dose de 25 mg).
Efeito da comida:Um ensaio de efeito alimentar envolvendo a administração de comprimidos de sumatriptano 100 mg a voluntários saudáveis em jejum e com uma refeição rica em gordura indicou que a Cmáx. e a AUC aumentaram 15% e 12%, respectivamente, quando administrados no estado alimentado.
Distribuição
A ligação às proteínas, determinada por diálise de equilíbrio na faixa de concentração de 10 a 1.000 ng/mL, é baixa, aproximadamente 14% a 21%. O efeito do sumatriptano na ligação às proteínas de outros medicamentos não foi avaliado. O volume aparente de distribuição é de 2,7 L/kg.
Metabolismo
Em vitro estudos com microssomas humanos sugerem que o sumatriptano é metabolizado pela MAO, predominantemente pela isoenzima A. A maior parte de uma dose radiomarcada de sumatriptano excretada na urina é o principal metabólito ácido indol acético (IAA) ou o glicuronídeo IAA, ambos inativos.
Eliminação
A meia-vida de eliminação do sumatriptano é de aproximadamente 2,5 horas. Radiomarcado 14O C-sumatriptano administrado por via oral é amplamente excretado por via renal (cerca de 60%), sendo cerca de 40% encontrado nas fezes. A maior parte do composto radiomarcado excretado na urina é o principal metabólito, IAA, que é inativo, ou o glicuronídeo IAA. Apenas 3% da dose pode ser recuperada como sumatriptano inalterado.
Populações Específicas
Idade: A farmacocinética do sumatriptano nos idosos (idade média: 72 anos, 2 homens e 4 mulheres) e em indivíduos com enxaqueca (idade média: 38 anos, 25 homens e 155 mulheres) foi semelhante à dos indivíduos saudáveis do sexo masculino (idade média: 30 anos).
Pacientes com Insuficiência Renal: O efeito da insuficiência renal na farmacocinética do sumatriptano não foi examinado.
Pacientes com insuficiência hepática: O fígado desempenha um papel importante na depuração pré-sistêmica do sumatriptano administrado por via oral. Consequentemente, a biodisponibilidade do sumatriptano após administração oral pode aumentar acentuadamente em pacientes com doença hepática. Num pequeno ensaio de pacientes com insuficiência hepática moderada (n = 8) pareados por sexo, idade e peso com indivíduos saudáveis (n = 8), os pacientes com insuficiência hepática tiveram um aumento de aproximadamente 70% na AUC e Cmáx. e um Tmáx. 40 minutos antes em comparação com os indivíduos saudáveis.
A farmacocinética do sumatriptano em pacientes com insuficiência hepática grave não foi estudada. O uso de comprimidos de sumatriptano nesta população é contraindicado.
Pacientes masculinos e femininos: Num ensaio que comparou mulheres e homens, não foram observadas diferenças farmacocinéticas entre géneros para AUC, Cmáx.Tmáx.e meia-vida.
Grupos raciais:A depuração sistêmica e Cmáx. de sumatriptano subcutâneo foram semelhantes em indivíduos saudáveis do sexo masculino negros (n = 34) e caucasianos (n = 38). O sumatriptano oral não foi avaliado quanto a diferenças raciais.
Estudos de interação medicamentosa
Inibidores da monoamina oxidase-A: O tratamento com inibidores da MAO-A geralmente leva a um aumento dos níveis plasmáticos de sumatriptano.
Devido aos efeitos de primeira passagem metabólica intestinal e hepática, o aumento da exposição sistémica após a co-administração de um inibidor da MAO-A com sumatriptano oral é maior do que após a co-administração dos inibidores da MAO com sumatriptano subcutâneo.
Num ensaio com 14 mulheres saudáveis, o pré-tratamento com um inibidor da MAO-A diminuiu a depuração do sumatriptano subcutâneo, resultando num aumento de 2 vezes na área sob a curva de concentração plasmática-tempo (AUC) do sumatriptano, correspondendo a um aumento de 40% na meia-vida de eliminação.
Um pequeno ensaio que avaliou o efeito do pré-tratamento com um inibidor da MAO-A na biodisponibilidade de um comprimido oral de sumatriptano de 25 mg resultou num aumento de aproximadamente 7 vezes na exposição sistémica.
Álcool: O álcool consumido 30 minutos antes da ingestão do sumatriptano não teve efeito na farmacocinética do sumatriptano.
13. Toxicologia Não Clínica
13.1 Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Em estudos de carcinogenicidade em camundongos e ratos, o sumatriptano foi administrado por via oral durante 78 e 104 semanas, respectivamente, em doses de até 160 mg/kg/dia (a dose elevada em ratos foi reduzida de 360 mg/kg/dia durante a semana 21). Não houve evidência em nenhuma das espécies de aumento de tumores relacionados à administração de sumatriptano. As exposições plasmáticas (AUC) nas doses mais altas testadas foram 20 e 8 vezes maiores que em humanos na dose humana máxima recomendada (MRHD) de 200 mg/dia.
Mutagênese
O sumatriptano foi negativo em em vitro (mutação reversa bacteriana [Ames]mutação de células genéticas em hamster chinês V79/HGPRT, aberração cromossômica em linfócitos humanos) e na Vivo (micronúcleo de rato) ensaios.
Comprometimento da fertilidade
Quando sumatriptano (5, 50, 500 mg/kg/dia) foi administrado por via oral a ratos machos e fêmeas antes e durante o período de acasalamento, houve uma diminuição na fertilidade relacionada ao tratamento, secundária a uma diminuição no acasalamento em animais tratados com doses superior a 5 mg/kg/dia (menos que o MRHD em mg/m22 base). Não está claro se esta descoberta se deveu a um efeito nos homens, nas mulheres ou em ambos.
Quando o sumatriptano foi administrado por injeção subcutânea a ratos machos e fêmeas antes e durante o período de acasalamento, não houve evidência de fertilidade prejudicada em doses de até 60 mg/kg/dia.
13.2 Toxicologia e/ou Farmacologia Animal
Opacidades da córnea
Os cães que receberam sumatriptano oral desenvolveram opacidades da córnea e defeitos no epitélio da córnea. Opacidades da córnea foram observadas na dose mais baixa testada, 2 mg/kg/dia, e estavam presentes após 1 mês de tratamento. Defeitos no epitélio da córnea foram observados em um estudo de 60 semanas. Não foram realizados exames anteriores para estas toxicidades e não foram estabelecidas doses sem efeito. A exposição plasmática na dose mais baixa testada foi aproximadamente 2 vezes maior que em humanos no MRHD.
14. Estudos Clínicos
A eficácia dos comprimidos de sumatriptano no tratamento agudo da enxaqueca foi demonstrada em 3 ensaios randomizados, duplo-cegos e controlados por placebo. Os doentes incluídos nestes 3 ensaios eram predominantemente do sexo feminino (87%) e caucasianos (97%), com uma idade média de 40 anos (intervalo: 18 a 65 anos). Os pacientes foram instruídos a tratar uma dor de cabeça moderada a grave. A resposta à dor de cabeça, definida como uma redução na gravidade da dor de cabeça de dor moderada ou intensa para dor leve ou nenhuma dor, foi avaliada até 4 horas após a administração. Sintomas associados como náusea, fotofobia e fonofobia também foram avaliados. A manutenção da resposta foi avaliada até 24 horas após a dose. Uma segunda dose de comprimidos de sumatriptano ou outro medicamento foi permitida 4 a 24 horas após o tratamento inicial para dor de cabeça recorrente. O paracetamol foi oferecido aos pacientes nos Ensaios 2 e 3, começando 2 horas após o tratamento inicial, se a dor da enxaqueca não tivesse melhorado ou piorado. Medicamentos adicionais foram permitidos 4 a 24 horas após o tratamento inicial para dor de cabeça recorrente ou como resgate em todos os três ensaios. A frequência e o tempo de uso desses suplementos tratamentos onais também foram determinados. Em todos os ensaios, doses de 25, 50 e 100 mg foram comparadas com placebo no tratamento de crises de enxaqueca. Num ensaio, as doses de 25, 50 e 100 mg também foram comparadas entre si.
Nos três ensaios, a percentagem de doentes que obtiveram resposta à dor de cabeça 2 e 4 horas após o tratamento foi significativamente maior entre os doentes que receberam comprimidos de sumatriptano em todas as doses, em comparação com aqueles que receberam placebo. Em 1 dos 3 ensaios, houve uma porcentagem maior estatisticamente significativa de pacientes com resposta de dor de cabeça em 2 e 4 horas no grupo de 50 mg ou 100 mg em comparação com os grupos de dose de 25 mg. Não houve diferenças estatisticamente significativas entre os grupos de dose de 50 mg e 100 mg em qualquer ensaio. Os resultados dos 3 ensaios clínicos controlados estão resumidos na Tabela 2.
| Sumatriptano Comprimidos 25mg |
Sumatriptano Comprimidos 50mg |
Sumatriptano Comprimidos 100mg |
Placebo | |||||
| 2 horas | 4 horas | 2 horas | 4 horas | 2 horas | 4 horas | 2 horas | 4 horas | |
| Teste 1 | 52% a | 67% a | 61% um,b | 78% um,b | 62% um,b | 79% um,b | 27% | 38% |
| (n = 298) | (n = 296) | (n = 296) | (n = 94) | |||||
| Teste 2 | 52% a | 70% a | 50% a | 68% a | 56% a | 71% a | 26% | 38% |
| (n = 66) | (n = 62) | (n = 66) | (n = 65) | |||||
| Teste 3 | 52% a | 65% a | 54% a | 72% a | 57% a | 78% a | 17% | 19% |
| (n = 48) | (n = 46) | (n = 46) | (n = 47) | |||||
a P<0,05 em comparação com placebo.
b P<0,05 em comparação com 25 mg.
A probabilidade estimada de obter uma resposta inicial à dor de cabeça ao longo das 4 horas após o tratamento nos Ensaios agrupados 1, 2 e 3 está representada na Figura 1.
Figura 1. Probabilidade estimada de obter resposta inicial à dor de cabeça dentro de 4 horas de tratamento nos ensaios agrupados 1, 2 e 3a
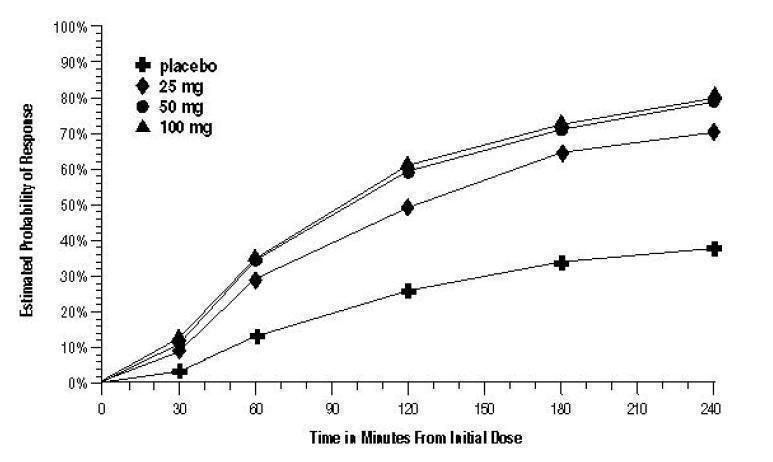
a A figura mostra a probabilidade ao longo do tempo de obter resposta à dor de cabeça (nenhuma ou dor leve) após tratamento com sumatriptano oral. As médias apresentadas baseiam-se em dados agrupados de 3 ensaios clínicos controlados que fornecem provas de eficácia. Gráfico de Kaplan-Meier com pacientes que não obtiveram resposta e/ou foram resgatados em 240 minutos, censurados para 240 minutos.
Para pacientes com náuseas, fotofobia e/ou fonofobia associadas à enxaqueca no início do estudo, houve uma menor incidência desses sintomas 2 horas (Ensaio 1) e 4 horas (Ensaios 1, 2 e 3) após a administração de comprimidos de sumatriptano comparado com placebo.
Já em 2 horas nos Ensaios 2 e 3, ou em 4 horas no Ensaio 1, até 24 horas após a dose inicial do tratamento do estudo, os pacientes foram autorizados a usar tratamento adicional para alívio da dor na forma de uma segunda dose de tratamento do estudo ou outro medicamento. A probabilidade estimada de pacientes tomarem uma segunda dose ou outro medicamento para enxaqueca nas 24 horas seguintes à dose inicial do tratamento do estudo está resumida na Figura 2.
Figura 2. A probabilidade estimada de pacientes tomarem uma segunda dose de comprimidos de sumatriptano ou outro medicamento para tratar a enxaqueca nas 24 horas seguintes à dose inicial do tratamento do estudo nos ensaios agrupados 1, 2 e 3a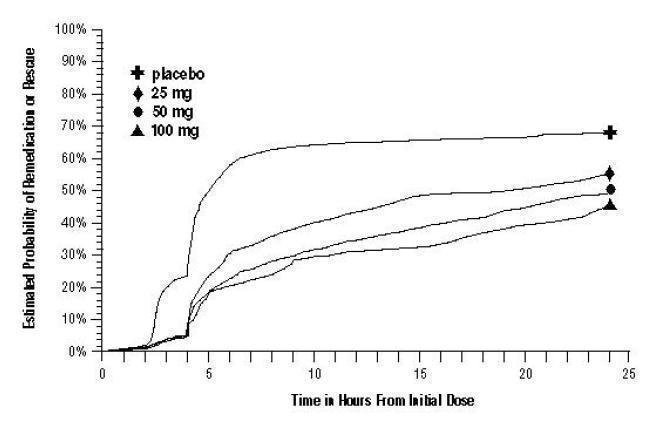
a Gráfico de Kaplan-Meier baseado em dados obtidos nos 3 ensaios clínicos controlados que fornecem evidências de eficácia em pacientes que não utilizam tratamentos adicionais censurados para 24 horas. O gráfico também inclui pacientes que não responderam à dose inicial. Nenhuma medicação foi permitida dentro de 2 horas após a dose.
Há evidências de que doses acima de 50 mg não proporcionam efeito maior que 50 mg. Não houve evidências que sugerissem que o tratamento com comprimidos de sumatriptano estivesse associado a um aumento na gravidade das dores de cabeça recorrentes. A eficácia dos comprimidos de sumatriptano não foi afetada pela presença de aura; duração da dor de cabeça antes do tratamento; sexo, idade ou peso do sujeito; relação com a menstruação; ou uso concomitante de medicamentos profiláticos comuns para enxaqueca (por exemplo, betabloqueadores, bloqueadores dos canais de cálcio, antidepressivos tricíclicos). Não havia dados suficientes para avaliar o impacto da raça na eficácia.
16. Como é fornecido o Sumatriptano
Comprimidos de sumatriptano USP, 25 mg, 50 mg e 100 mg de sumatriptano (base) como succinato.
Os comprimidos de sumatriptano USP, 25 mg são de cor amarela, revestidos por película, triangulares biconvexos com a gravação “S” em um lado e “102” no outro lado, fornecidos em embalagens de dose unitária – Embalagem com 9 comprimidos de dose unitária (1 x 9s) cada um com perfuração cruzada e rotulado individualmente. NDC 69452-344-72
Os comprimidos de sumatriptano USP, 50 mg são de cor rosa, revestidos por película, triangulares biconvexos com a gravação “S” em um lado e “103” no outro lado, fornecidos em embalagens de dose unitária – Embalagem com 9 comprimidos de dose unitária (1 x 9s) cada um com perfuração cruzada e rotulado individualmente. NDC 69452-345-72
Os comprimidos de sumatriptano USP, 100 mg são brancos a esbranquiçados, revestidos por película, triangulares biconvexos com a gravação “S” em um lado e “104” no outro lado, fornecidos em embalagens de dose unitária – Embalagem com 9 comprimidos de dose unitária (1 x 9s) cada um com perfuração cruzada e etiquetado individualmente. NDC 69452-346-72
Armazenar entre 20° e 25°C (68° e 77°F).
17. Informações de aconselhamento ao paciente
Aconselhe o paciente a ler a rotulagem do paciente aprovada pela FDA (Informações do Paciente).
Risco de isquemia e/ou infarto miocárdico, angina de Prinzmetal, outros eventos relacionados ao vasoespasmo, arritmias e eventos cerebrovasculares
Informe os pacientes que os comprimidos de sumatriptano podem causar efeitos colaterais cardiovasculares graves, como infarto do miocárdio ou acidente vascular cerebral. Embora eventos cardiovasculares graves possam ocorrer sem sintomas de alerta, os pacientes devem estar atentos aos sinais e sintomas de dor no peito, falta de ar, batimentos cardíacos irregulares, aumento significativo da pressão arterial, fraqueza e fala arrastada, e devem procurar orientação médica se qualquer sinal ou sintoma indicativo for observado. Alertar os pacientes sobre a importância desse acompanhamento.
Reações Anafiláticas/Anafilactóides
Informe os pacientes que ocorreram reações anafiláticas / anafilactóides em pacientes que receberam comprimidos de sumatriptano. Tais reações podem ser fatais ou fatais. Em geral, as reações anafiláticas a medicamentos são mais prováveis de ocorrer em indivíduos com histórico de sensibilidade a múltiplos alérgenos.
Uso concomitante com outros triptanos ou medicamentos para ergotina
Informe os pacientes que o uso de comprimidos de sumatriptano dentro de 24 horas após outro triptano ou um medicamento do tipo ergotamina (incluindo diidroergotamina ou metisergida) é contra-indicado.
Síndrome da serotonina
Alertar os pacientes sobre o risco de síndrome da serotonina com o uso de comprimidos de sumatriptano ou outros triptanos, particularmente durante o uso combinado com ISRSs, IRSNs, ADTs e inibidores da MAO.
Dor de cabeça por uso excessivo de medicamentos
Informar os pacientes que o uso de medicamentos para enxaqueca aguda por 10 ou mais dias por mês pode levar a uma exacerbação da dor de cabeça e incentivar os pacientes a registrarem a frequência da dor de cabeça e o uso de medicamentos (por exemplo, mantendo um diário de dor de cabeça).
Gravidez
Aconselhe as pacientes a notificarem seu médico se engravidarem durante o tratamento ou planejarem engravidar.
Lactação
Aconselhe as pacientes a notificarem seu médico se estiverem amamentando ou planejando amamentar.
Capacidade de executar tarefas complexas
O tratamento com comprimidos de sumatriptano pode causar sonolência e tonturas; instrua os pacientes a avaliar sua capacidade de realizar tarefas complexas após a administração de comprimidos de sumatriptano.
INFORMAÇÃO DO PACIENTE
Comprimidos de sumatriptano (sue-mah-TRIP-tan), USP
Qual é a informação mais importante que devo saber sobre os comprimidos de sumatriptano?
Os comprimidos de sumatriptano podem causar efeitos colaterais graves, incluindo:
Ataque cardíaco e outros problemas cardíacos. Problemas cardíacos podem levar à morte.
Pare de tomar comprimidos de sumatriptano e procure ajuda médica de emergência imediatamente se tiver algum dos seguintes sintomas de ataque cardíaco:
- desconforto no centro do peito que dura mais de alguns minutos ou que passa e volta
- forte aperto, dor, pressão ou peso no peito, garganta, pescoço ou mandíbula
- dor ou desconforto nos braços, costas, pescoço, mandíbula ou estômago
- falta de ar com ou sem desconforto no peito
- começando a suar frio
- náusea ou vômito
- sentindo-se tonto
Os comprimidos de sumatriptano não são indicados para pessoas com fatores de risco para doenças cardíacas, a menos que um exame cardíaco seja realizado e não mostre nenhum problema. Você tem um risco maior de doença cardíaca se:
- tem pressão alta
- tem níveis elevados de colesterol
- fumaça
- estão acima do peso
- tem diabetes
- tem histórico familiar de doença cardíaca
O que são comprimidos de sumatriptano?
Os comprimidos de sumatriptano são um medicamento de prescrição usado para tratar enxaquecas agudas com ou sem aura em adultos.
Os comprimidos de sumatriptano não são utilizados para tratar outros tipos de dores de cabeça, como enxaquecas hemiplégicas (que impedem você de se mover de um lado do corpo) ou enxaquecas basilares (forma rara de enxaqueca com aura).
Os comprimidos de sumatriptano não são usados para prevenir ou diminuir o número de enxaquecas que você tem.
Não se sabe se os comprimidos de sumatriptano são seguros e eficazes no tratamento de dores de cabeça em salvas.
Não se sabe se os comprimidos de sumatriptano são seguros e eficazes em crianças menores de 18 anos.
Não tome comprimidos de sumatriptano se tiver:
- problemas cardíacos ou histórico de problemas cardíacos
- estreitamento dos vasos sanguíneos nas pernas, braços, estômago ou rins (doença vascular periférica)
- pressão alta não controlada
- problemas hepáticos graves
- enxaquecas hemiplégicas ou enxaquecas basilares. Se você não tiver certeza se tem esses tipos de enxaqueca, pergunte ao seu médico.
- teve um acidente vascular cerebral, ataques isquêmicos transitórios (AIT) ou problemas com a circulação sanguínea
- tomou algum dos seguintes medicamentos nas últimas 24 horas:
- almotriptano (AXERT)
- eletriptano (RELPAX)
- frovatriptano (FROVA)
- naratriptano (AMERGE)
- rizatriptano (MAXALT, MAXALT-MLT)
- sumatriptano e naproxeno (TREXIMET)
- ergotaminas (CAFERGOT, ERGOMAR, MIGERGOT)
- diidroergotamina (DHE 45, MIGRANAL)
Pergunte ao seu médico se não tiver certeza se o seu medicamento está listado acima.
- alergia ao sumatriptano ou a qualquer um dos ingredientes dos comprimidos de sumatriptano. Consulte o final deste folheto para obter uma lista completa dos ingredientes dos comprimidos de sumatriptano.
Antes de tomar comprimidos de sumatriptano, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem pressão alta.
- tem colesterol alto.
- tem diabetes.
- fumaça.
- estão acima do peso.
- tem problemas cardíacos ou histórico familiar de problemas cardíacos ou derrame.
- tem problemas renais.
- tem problemas de fígado.
- teve epilepsia ou convulsões.
- não estão usando métodos anticoncepcionais eficazes.
- está grávida ou planeja engravidar. Não se sabe se os comprimidos de sumatriptano podem prejudicar o feto.
- estão amamentando ou planejam amamentar. Sumatriptano pa passa para o leite materno. Não se sabe se isso pode prejudicar seu bebê. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se você tomar comprimidos de sumatriptano.
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos com e sem prescrição, vitaminas e suplementos de ervas.
Os comprimidos de sumatriptano e alguns outros medicamentos podem afetar-se mutuamente, causando efeitos colaterais graves.
Informe especialmente o seu médico se você toma medicamentos antidepressivos chamados:
- inibidores seletivos da recaptação da serotonina (ISRS)
- inibidores da recaptação de serotonina e norepinefrina (SNRIs)
- antidepressivos tricíclicos (ADTs)
- inibidores da monoamina oxidase (IMAOs)
Peça ao seu médico ou farmacêutico uma lista desses medicamentos se não tiver certeza.
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico ou farmacêutico quando você adquirir um novo medicamento.
Como devo tomar comprimidos de sumatriptano?
- Certas pessoas devem tomar a primeira dose de comprimidos de sumatriptano no consultório do seu médico ou em outro ambiente médico. Pergunte ao seu médico se você deve tomar a primeira dose em um ambiente médico.
- Tome os comprimidos de sumatriptano exatamente de acordo com as instruções do seu médico.
- O seu médico pode alterar a sua dose. Não altere a sua dose sem primeiro falar com o seu médico.
- Tome os comprimidos de sumatriptano inteiros com água ou outros líquidos.
- Se não obtiver nenhum alívio após o primeiro comprimido, não tome um segundo comprimido sem primeiro falar com o seu médico.
- Se a sua dor de cabeça voltar ou se você apenas sentir algum alívio da dor de cabeça, poderá tomar um segundo comprimido 2 horas após o primeiro comprimido.
- Não tome mais de 200 mg de comprimidos de sumatriptano num período de 24 horas.
- Se você tomar muito sumatriptano, ligue para seu médico ou vá imediatamente ao pronto-socorro do hospital mais próximo.
- Você deve anotar quando tiver dores de cabeça e quando tomar comprimidos de sumatriptano para poder conversar com seu médico sobre como os comprimidos de sumatriptano estão funcionando para você.
O que devo evitar ao tomar comprimidos de sumatriptano?
Os comprimidos de sumatriptano podem causar tonturas, fraqueza ou sonolência. Se você tiver esses sintomas, não dirija, use máquinas ou faça qualquer coisa que precise estar alerta.
Quais são os possíveis efeitos colaterais dos comprimidos de sumatriptano?
Os comprimidos de sumatriptano podem causar efeitos colaterais graves. Consulte “Qual é a informação mais importante que devo saber sobre os comprimidos de sumatriptano?”
Esses efeitos colaterais graves incluem:
- alterações na cor ou sensação nos dedos das mãos e dos pés (síndrome de Raynaud)
- problemas estomacais e intestinais (eventos isquêmicos gastrointestinais e colônicos). Os sintomas de eventos isquêmicos gastrointestinais e colônicos incluem:
- dor de estômago súbita ou intensa
- náusea ou vômito
- dor de estômago após as refeições
- constipação ou diarréia
- perda de peso
- diarréia com sangue
- febre
- problemas de circulação sanguínea nas pernas e pés (isquemia vascular periférica). Os sintomas de isquemia vascular periférica incluem:
- cólicas e dor nas pernas ou quadris
- sensação de peso ou aperto nos músculos das pernas
- dor ardente ou dolorida nos pés ou dedos dos pés durante o repouso
- dormência, formigamento ou fraqueza nas pernas
- sensação de frio ou mudanças de cor em uma ou ambas as pernas ou pés
- dores de cabeça por uso excessivo de medicamentos. Algumas pessoas que usam muitos comprimidos de sumatriptano podem ter dores de cabeça piores (dor de cabeça por uso excessivo de medicamentos). Se as suas dores de cabeça piorarem, o seu médico pode decidir interromper o tratamento com comprimidos de sumatriptano.
- síndrome da serotonina. A síndrome da serotonina é um problema raro, mas grave, que pode ocorrer em pessoas que usam comprimidos de sumatriptano, especialmente se os comprimidos de sumatriptano forem usados com medicamentos antidepressivos chamados ISRS ou SNRIs.
Ligue para o seu médico imediatamente se tiver algum dos seguintes sintomas da síndrome da serotonina:
- alterações mentais, como ver coisas que não existem (alucinações), agitação ou coma
- batimento cardíaco acelerado
- mudanças na pressão arterial
- temperatura corporal elevada
- músculos tensos
- dificuldade para andar
- urticária (inchaços que coçam); inchaço da língua, boca ou garganta
- convulsões. Convulsões ocorreram em pessoas que tomaram comprimidos de sumatriptano e que nunca tiveram convulsões antes. Converse com seu médico sobre a chance de ter convulsões enquanto toma comprimidos de sumatriptano.
Os efeitos colaterais mais comuns dos comprimidos de sumatriptano incluem:
- formigamento ou dormência nos dedos das mãos ou dos pés
- sensação de calor ou frio
- sentindo-se fraco, sonolento ou cansado
- dor, desconforto ou rigidez no pescoço, garganta, mandíbula ou peito
- tontura
Informe o seu médico se você tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais dos comprimidos de sumatriptano. Ligue para seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA pelo telefone 1-800-FDA-1088.
Como devo armazenar os comprimidos de sumatriptano?
Armazene os comprimidos de sumatriptano entre 20 ° e 25 ° C (68 ° a 77 ° F).
Mantenha os comprimidos de sumatriptano e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de comprimidos de sumatriptano.
Às vezes, os medicamentos são prescritos para fins diferentes dos listados nos folhetos informativos do paciente. Não use comprimidos de sumatriptano para uma condição para a qual não foram prescritos. Não dê comprimidos de sumatriptano a outras pessoas, mesmo que elas apresentem os mesmos sintomas que você. Eles podem prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre os comprimidos de sumatriptano. Se desejar mais informações, converse com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre os comprimidos de sumatriptano escritos para profissionais de saúde.
Para obter mais informações, ligue para Bionpharma Inc. em 1-888-235-BION ou 1-888-235-2466.
Quais são os ingredientes dos comprimidos de sumatriptano?
Ingrediente ativo: succinato de sumatriptano, USP
Ingredientes inativos: croscarmelose sódica, fosfato de cálcio dibásico, estearato de magnésio, celulose microcristalina, bicarbonato de sódio e opadry. Os componentes do opadry amarelo utilizados na formulação dos comprimidos de 25 mg são hipromelose, dióxido de titânio, polietilenoglicol 6000, óxido de ferro amarelo e polissorbato 80. Os componentes do opadry rosa utilizados na formulação dos comprimidos de 50 mg são hipromelose, dióxido de titânio, polietilenoglicol 400 e óxido de ferro vermelho. Os componentes do opadry white utilizados na formulação dos comprimidos de 100 mg são hipromelose, dióxido de titânio e polietilenoglicol 400.
As marcas listadas neste folheto informativo ao paciente são marcas registradas de seus respectivos proprietários e não são marcas registradas da Bionpharma Inc. Os fabricantes dessas marcas não são afiliados e não endossam a Bionpharma Inc.